
| 28x+42y |
| x+y |
| (b-2a)mol |
| 0.1L |


科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 向无色溶液中滴加盐酸,振荡 | 生成无色无味且能使澄清石灰水变浑浊的气体 | 原溶液中有CO32- |
| B | 向Na2CO3饱和溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3 |
| C | 将少量氯气通入FeI2中 | 浅绿色变为棕黄色 | 2Fe2++Cl2=2Fe3++2Cl- |
| D | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
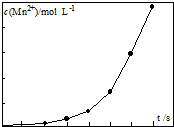 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:
| ||
| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
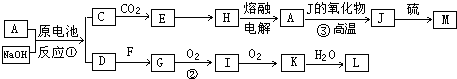 A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去).
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol/L |
| B、0.9mol/L |
| C、1.0mol/L |
| D、1.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com