
【题目】工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6 NOx![]() (2x + 3)N2 + 6xH2O某化学兴趣小组模拟该处理过程的实验装置如下:
(2x + 3)N2 + 6xH2O某化学兴趣小组模拟该处理过程的实验装置如下:

①装置A中发生反应的化学方程式为_______。
②装置D中碱石灰的作用是______。
(2)工业上也常用Na2CO3溶液吸收法处理NOx。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①将1molNOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如下图所示,则图中线段a表示______离子随x值变化的关系;

②为了检测吸收液中NaNO2含量,某兴趣小组取100ml该吸收液,用0.005mol·L–1的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液的体积为16.00mL。(已知:2MnO4–+5NO2–+6H+=2Mn2++5NO3–+3H2O)。则吸收液中NaNO2的物质的量浓度为多少?__________
【答案】2NH4Cl +Ca(OH)2![]() CaCl2+ 2NH3↑ + 2H2O 除去气体中含有的水蒸气 NO2– 0.002mol·L–1
CaCl2+ 2NH3↑ + 2H2O 除去气体中含有的水蒸气 NO2– 0.002mol·L–1
【解析】
(1)①装置A中,NH4Cl 与Ca(OH)2发生复分解反应,生成CaCl2 、NH3、H2O。
②装置D中碱石灰的作用是干燥氨气。
(2)①当x=0.5时,气体的平均组成为NO1.5,此时NO、NO2按体积比为1:1混合,只发生反应(I),随着x的不断增大,NO2的含量不断增多,此时不仅发生反应(I),还发生反应(II)。只有发生反应(II)后,溶液中才生成NO3ˉ,由此可得出图中线段a表示的离子;
②设NaNO2的物质的量为x
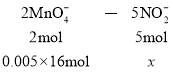
![]() =0.0002mol,再求c(NaNO2)。
=0.0002mol,再求c(NaNO2)。
(1)①装置A中,NH4Cl 与Ca(OH)2发生复分解反应,生成CaCl2 、NH3、H2O,反应的化学方程式为2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑ + 2H2O。答案为:2NH4Cl +Ca(OH)2
CaCl2 + 2NH3↑ + 2H2O。答案为:2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑ + 2H2O;
CaCl2 + 2NH3↑ + 2H2O;
②装置D中碱石灰的作用是干燥氨气(或除去气体中含有的水蒸气)。答案为:除去气体中含有的水蒸气;
(2)①当x=0.5时,气体的平均组成为NO1.5,此时NO、NO2按体积比为1:1混合,只发生反应(I),随着x的不断增大,NO2的含量不断增多,此时不仅发生反应(I),还发生反应(II)。只有发生反应(II)后,溶液中才生成NO3ˉ,由此可得出图中线段a表示的离子为NO2–;答案为:NO2–;
②设NaNO2的物质的量为x
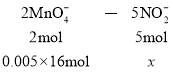
![]() =0.0002mol,再求c(NaNO2)=
=0.0002mol,再求c(NaNO2)=![]() =0.002mol·L–1。答案为:0.002mol·L–1。
=0.002mol·L–1。答案为:0.002mol·L–1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图所示所得出的结论正确的是
A.图甲是一定温度下,处于恒容密闭容器、弱酸性环境下的铁钉发生腐蚀过程中体系压强的变化曲线,可推知初始阶段铁钉主要发生析氢腐蚀
B.图乙是平衡体系2NO2(g)![]() N2O4(g);ΔH=-56.9 kJ·mol-1改变某一条件后v(正)、v(逆)的变化情况,可推知t0时刻改变的条件是升高温度
N2O4(g);ΔH=-56.9 kJ·mol-1改变某一条件后v(正)、v(逆)的变化情况,可推知t0时刻改变的条件是升高温度
C.图丙是某温度下c(CH3COOH)+c(CH3COO-)=0.100 mol·L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系,可推知该温度下pH=3的溶液中:Ka<10-4.75
D.图丁中虚线是2SO2+O2![]() 2SO3在催化剂存在下反应过程中能量的变化情况,可推知催化剂Ⅰ的催化效果更好
2SO3在催化剂存在下反应过程中能量的变化情况,可推知催化剂Ⅰ的催化效果更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整_________。
(2)实验中他们取6.4 g铜片和12 mL 18 mol·L1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:__________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是__________________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是________(填编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)装置C中试管D内盛装的是品红溶液,当B中气体收集满后,有可能观察到的现象是_____________,待反应结束后,向C中烧杯内加入沸水,D中观察到的现象是_____________。
(4)实验装置C有可能造成环境污染,试用最简单的方法加以解决,__________________(实验用品自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是
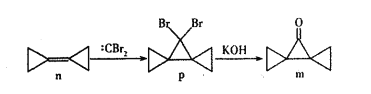
A. n分子中所有原子都在同一个平面上
B. n和:CBr2生成p的反应属于加成反应
C. p分子中极性键和非极性键数目之比为2:9
D. m分子同分异构体中属于芳香族化合物的共有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关化学知识进行判断,下列结论错误的是( )
A.蛋白质水解的最终产物是氨基酸
B.向饱和硼酸溶液中滴加![]() 溶液,有
溶液,有![]() 气体生成
气体生成
C.某吸热反应能自发进行,因此该反应是熵增反应
D.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线,下列说法正确的是
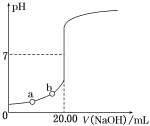
A. 水电离出的氢离子浓度:a<b
B. 盐酸的物质的量浓度为0.010 0 mol·L-1
C. 指示剂变色时,说明盐酸与NaOH恰好完全反应
D. 当滴加NaOH溶液为10.00 mL时,该混合液的pH=1+lg 3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com