
【题目】下列物质中,属于含有共价键的离子化合物的是( )
A.CH3CH3B.Na2O2C.NaClD.N2
【答案】B
【解析】
含阴阳离子的化合物是离子化合物,阴阳离子之间的作用力是离子键,相邻原子间通过共用电子对而产生的作用力是共价键。CH3CH3和N2形成的是分子,不含离子,因此不是离子化合物;Na2O2和NaCl由阴阳离子构成,是离子化合物,但NaCl中不含共价键,而Na2O2中含共价键。
A项、CH3CH3的结构为![]() ,C-H键、C-C键均为共价键,A选项错误;
,C-H键、C-C键均为共价键,A选项错误;
B项、Na2O2由Na+和O22-构成,Na+和O22-之间是离子键,而O22-中氧原子之间是共价键,B选项正确;
C项、NaCl由Na+和Cl-构成,Na+和Cl-之间是离子键,没有共价键,C选项错误;
D项、N2 分子结构是N≡N,只有共价键,没有离子键,D选项错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6 NOx![]() (2x + 3)N2 + 6xH2O某化学兴趣小组模拟该处理过程的实验装置如下:
(2x + 3)N2 + 6xH2O某化学兴趣小组模拟该处理过程的实验装置如下:

①装置A中发生反应的化学方程式为_______。
②装置D中碱石灰的作用是______。
(2)工业上也常用Na2CO3溶液吸收法处理NOx。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①将1molNOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如下图所示,则图中线段a表示______离子随x值变化的关系;

②为了检测吸收液中NaNO2含量,某兴趣小组取100ml该吸收液,用0.005mol·L–1的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液的体积为16.00mL。(已知:2MnO4–+5NO2–+6H+=2Mn2++5NO3–+3H2O)。则吸收液中NaNO2的物质的量浓度为多少?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钾(![]() )能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
)能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
I.制备
步骤1:制备亚硝酸丁酯(![]() )
)
![]()
反应装置如图1(夹持装置略去),向烧杯中依次加入稀硫酸、丁醇、亚硝酸钠溶液,待反应完全后,分离出上层油状物,用![]() 和
和![]() 的混合溶液洗涤三次,经干燥后备用。
的混合溶液洗涤三次,经干燥后备用。
步骤2:制备叠氮化钾
![]()
反应装置如图2(夹持及加热装置路去),向仪器A中加入![]() 乙醇溶液、
乙醇溶液、![]() 的联氨(
的联氨(![]() )、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于
)、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于![]() 干燥。
干燥。


相关物质性质如下:
物质 | 颜色、状态 | 沸点(℃) | 溶解性 |
| 无色晶体 | 受热易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
| 无色液休 | 118 | 微溶于水,与乙醇、乙醚混溶 |
| 无色或淡黄色油状液体 | 78 | 不溶于水,与乙醇、乙醚混溶 |
| 无色油状液体 | 118 | 与水、乙醇混溶,不溶于乙醚 |
请回答:
(1)仪器A的名称为_____________.
(2)步骤1中分离出亚硝酸丁酯的操作名称为_____________;步骤1中用NaCl和NaHCO3的混合溶液洗涤的目的是__________________________.
(3)步骤2中冰浴冷却的目的是__________________________;步骤2中干燥产品的温度控制在55~60℃,原因是__________________________
(4)如需提高产品的纯度,可在_____________(填编号)中进行重结晶。
A.无水乙醇 B.无水乙醚 C.水 D.乙醇的水溶液
Ⅱ.分光光度法测定产品的纯度
原理:![]() 与
与![]() 反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“
反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“![]() 吸光度”曲线确定样品溶液中的
吸光度”曲线确定样品溶液中的![]() 。测定步骤如下:
。测定步骤如下:
①用![]() 品体配制
品体配制![]() 标准溶液;
标准溶液;
②配制一组相同体积(![]() )不同浓度的
)不同浓度的![]() 标准溶液,分别加入
标准溶液,分别加入![]() (足量)
(足量)![]() 标准溶液,摇匀,测量吸光度,绘制标准溶液的
标准溶液,摇匀,测量吸光度,绘制标准溶液的![]() 与吸光度的关系曲线,如图;
与吸光度的关系曲线,如图;
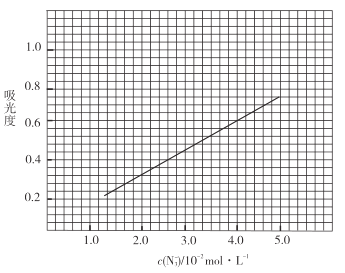
③产品测定:称取0.360g产品,配成![]() 溶液,取出
溶液,取出![]() 于标准管中,加入
于标准管中,加入![]() (足量)
(足量)![]() 标准溶液,摇匀,测得吸光度为0.6。
标准溶液,摇匀,测得吸光度为0.6。
(5)实验室用![]() 晶体配制
晶体配制![]() 标准溶液的方法为_________________.
标准溶液的方法为_________________.
(6)产品的纯度为_________________;若③中加入的![]() 标准溶液不足以将产品完全反应,则测得的产品纯度________________(填“偏高”“偏低”或“无影响”)。
标准溶液不足以将产品完全反应,则测得的产品纯度________________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lg c(SO42-)。下列说法正确的是( )
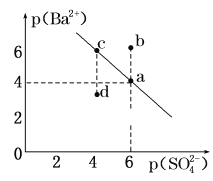
A.加入BaCl2可以使溶液由c点变到a点
B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C.d点表示的是该温度下BaSO4的不饱和溶液
D.该温度下,Ksp(BaSO4)=1.0×10-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)![]() 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入![]() ,制备
,制备![]() ,生成
,生成![]()
![]() ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向![]() 溶液中加入适量
溶液中加入适量![]() ,生成
,生成![]() 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)![]() 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附![]() 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有![]() 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为![]() ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
温度/℃ | n(C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是( )
A.由上述信息可推知:T1>T2
B.T2℃条件下,若反应达到平衡后再缩小容器的体积,c(N2):c(NO)增大
C.T1℃条件下,若开始时反应物的用量均减小一半, 平衡后NO的转化率增大
D.![]() ℃条件下,该反应的平衡常数
℃条件下,该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示,下列说法不正确的是( )
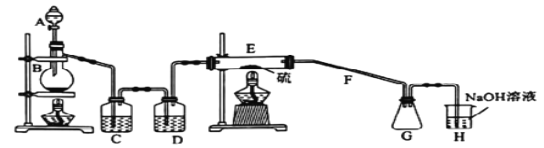
A. 实验时需后点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为S、H2S、HCl
D. G、H之间应加上D装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是( )
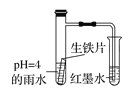
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.具支试管中溶液pH逐渐减小
D.墨水回升时,碳极反应式为O2+2H2O+4e–=4OH–
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com