
【题目】在不同温度下,向V L密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
温度/℃ | n(C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是( )
A.由上述信息可推知:T1>T2
B.T2℃条件下,若反应达到平衡后再缩小容器的体积,c(N2):c(NO)增大
C.T1℃条件下,若开始时反应物的用量均减小一半, 平衡后NO的转化率增大
D.![]() ℃条件下,该反应的平衡常数
℃条件下,该反应的平衡常数![]()
【答案】D
【解析】
A. 温度T2时,活性炭的平衡物质的量为0.375mol,则消耗的n(活性炭)=0.5mol0.375mol=0.125mol,故消耗的n(NO)=0.25mol,平衡时n(NO)=0.5mol0.25mol=0.25mol,生成的n(N2)=0.125mol,生成的n(CO2)=0.125mol,温度T1时,生成的n(CO2)=0.15mol,反应2NO(g)+C(s) ![]() N2(g)+CO2(g)△H=213.5kJ/mol,正反应为放热反应,升温平衡逆向移动,所以T1<T2,故A错误;
N2(g)+CO2(g)△H=213.5kJ/mol,正反应为放热反应,升温平衡逆向移动,所以T1<T2,故A错误;
B. 反应2NO(g)+C(s) ![]() N2(g)+CO2(g)是一个气体体积不变的反应,平衡后再缩小容器的体积,压强增大,但平衡不移动,故c(N2):c(NO)不变,故B错误;
N2(g)+CO2(g)是一个气体体积不变的反应,平衡后再缩小容器的体积,压强增大,但平衡不移动,故c(N2):c(NO)不变,故B错误;
C. 反应2NO(g)+C(s) ![]() N2(g)+CO2(g)是一个气体体积不变的反应,开始时反应物的用量均减小一半,压强减小,但平衡不移动,平衡后NO的转化率不变,故C错误;
N2(g)+CO2(g)是一个气体体积不变的反应,开始时反应物的用量均减小一半,压强减小,但平衡不移动,平衡后NO的转化率不变,故C错误;
D. 2NO(g)+C(s) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始量(mol) 0.5 0.5 0 0
变化量(mol) 0.3 0.15 0.15 0.15
平衡量(mol) 0.2 0.35 0.150.15
温度T1,平衡时c(NO)=![]() =
= ![]() mol/L,c(N2)=
mol/L,c(N2)=![]() mol/L,c(CO2)=
mol/L,c(CO2)= ![]() mol/L,平衡常数K=
mol/L,平衡常数K=![]() =
=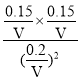 =
=![]() ,故D正确;
,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】运用相关化学知识进行判断,下列结论错误的是( )
A.蛋白质水解的最终产物是氨基酸
B.向饱和硼酸溶液中滴加![]() 溶液,有
溶液,有![]() 气体生成
气体生成
C.某吸热反应能自发进行,因此该反应是熵增反应
D.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个反应常温时的平衡常数的数值如表所示,以下说法错误的是![]()
![]()
![]()
![]()
![]()
![]()
![]()
A.常温下,NO分解产生![]() 的反应的平衡常数表达式为
的反应的平衡常数表达式为![]()
B.常温下,水分解产生![]() ,此时平衡常数的数值约为
,此时平衡常数的数值约为![]()
C.常温下,NO、![]() 、
、![]() 三种化合物分解放出
三种化合物分解放出![]() 的倾向由大到小的顺序为
的倾向由大到小的顺序为![]()
D.反应![]() 的平衡常数
的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是( )
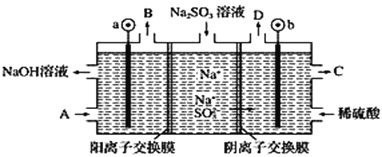
A.a电极发生还原反应,当有1 mol Na+通过阳离子交换膜时,a极生成11.2 L气体
B.若D是混合气体,则可能含有SO2、O2等成分
C.b电极上的主反应是![]() -2e-+H2O=
-2e-+H2O=![]() +2H+
+2H+
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C溶液是较浓的硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于焓变(ΔH)的叙述或判断中错误的是

A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的 ΔH<0
B. 500 ℃、30 MPa下,0.5 mol N2和1.5 mol H2充分反应放出 19.3 kJ 热量,则反应“N2(g)+3H2(g) ![]() 2NH3(g)”的 ΔH=-38.6 kJ·mol-1
2NH3(g)”的 ΔH=-38.6 kJ·mol-1
C. 据下图1 知:ΔH1 = ΔH2+ΔH3
D. 据下图2 知:E的大小对该反应的ΔH 无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时:有 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中 c(CH3COOH)、c(CH3COO-)与 pH 的关系如图所示,下列有关溶液中离子浓度的叙述正确的是( )
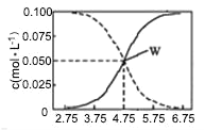
A.pH=3.5 的溶液中:c(Na+)+c(H+)—c(OH-)+c(CH3COOH)=0.1 mol·L-1
B.W 点所表示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-)
C.pH=5.5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向 W 点所表示的 1.0 L 溶液中通入 0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl![]() Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl![]() 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
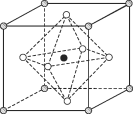
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
质量分数/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:

(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com