
【题目】25 ℃时:有 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中 c(CH3COOH)、c(CH3COO-)与 pH 的关系如图所示,下列有关溶液中离子浓度的叙述正确的是( )
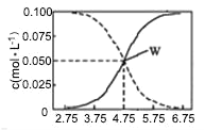
A.pH=3.5 的溶液中:c(Na+)+c(H+)—c(OH-)+c(CH3COOH)=0.1 mol·L-1
B.W 点所表示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-)
C.pH=5.5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向 W 点所表示的 1.0 L 溶液中通入 0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
【答案】A
【解析】
A. 由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1molL-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(CH3COOH)=0.1mol/L,故A正确;
B.W点由电荷守恒可知,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),而 c(CH3COO-)=c(CH3COOH),故有c(Na+)+c(H+)═c(CH3COOH)+c(OH-),故B错误;
C. 由图可知,pH=4.75时,c(CH3COO-)=c(CH3COOH),故当pH=5.5 时,有c(CH3COO-)>c(CH3COOH),且溶液显酸性,则c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),故C错误;
D. 向W点所表示溶液中通入0.05molHCl气体,与溶液中醋酸根恰好反应,反应后溶液近似为CH3COOH、NaCl混合溶液,溶液中氢离子源于CH3COOH、水的电离,根据质子守恒得:c(H+)═c(CH3COO)+c(OH),而此时c(CH3COO)≠c(CH3COOH),故D错误;
故选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
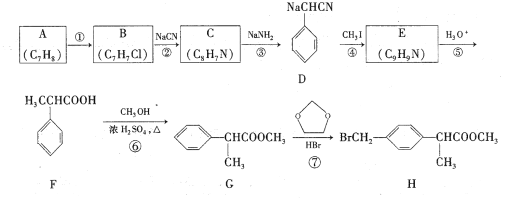
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
温度/℃ | n(C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是( )
A.由上述信息可推知:T1>T2
B.T2℃条件下,若反应达到平衡后再缩小容器的体积,c(N2):c(NO)增大
C.T1℃条件下,若开始时反应物的用量均减小一半, 平衡后NO的转化率增大
D.![]() ℃条件下,该反应的平衡常数
℃条件下,该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s) + H2O(g) =CO(g) + H2(g) ΔH=a kJ·mol-1
2C(s) +O2(g) =2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.+332B.+118C.+350D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示,下列说法不正确的是( )
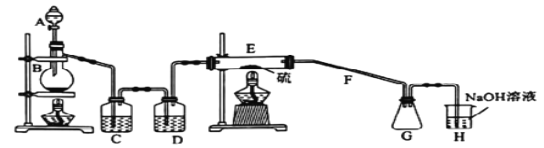
A. 实验时需后点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为S、H2S、HCl
D. G、H之间应加上D装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、医药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并有带刺激性气味的气体产生。实验室合成原理为SO2+ Cl2+ SCl2=2SOCl2装置如下图所示。请回答以下问题:
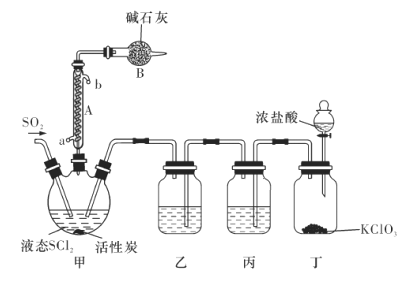
(1)仪器A的名称是________,装置乙中盛放的试剂是______装置B的作用是____________ 。
(2)装置丁中发生反应的离子方程式为___________________________。
(3)蒸干A1C13溶液不能得到无水A1C13,使SOCl2与A1C13·6H2O混合加热,可得到无水A1C13,试解释原因:_____________________________
(4)若反应中消耗的C12的体积为896 mL(已转化为标准状况下,SCl2、SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为________(保留三位有效数字)。
(5)常温下,将0. 01 mol SOCl2加人100 mL 0. 3 mol/L NaOH溶液中恰好完全反应,所得溶液呈__________________(填“酸”“碱”或“中”)性,溶液中所有阴离子的浓度大小顺序为________________。(已知H2SO3的![]() =1 .52×10-2,
=1 .52×10-2,![]() =1.02×10-7)
=1.02×10-7)
(6)将少量SOCl2滴人5 mL 1 mol/L的AgNO3溶液中,有白色沉淀生成,该白色沉淀的成分是________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是( )
A.CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为:2CO(g)+O2(g)=2CO2(g) △H=-283.0kJ·mol-1
B.当反应物的总能量比生成物的总能量高时,为吸热反应;当生成物的总能量比反应物的总能量高时,则为放热反应
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含lmolNaOH的溶液混合,放出的热量等于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com