
【题目】下图是用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线,下列说法正确的是
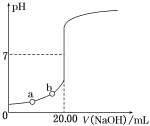
A. 水电离出的氢离子浓度:a<b
B. 盐酸的物质的量浓度为0.010 0 mol·L-1
C. 指示剂变色时,说明盐酸与NaOH恰好完全反应
D. 当滴加NaOH溶液为10.00 mL时,该混合液的pH=1+lg 3
【答案】AD
【解析】
用已知浓度的NaOH溶液滴定一定体积的未知浓度盐酸(酚酞作指示剂)过程中,溶液的pH、溶液中水的电离程度不断发生变化。理论上当NaOH溶液与盐酸恰好反应时,溶液pH=7;实验中滴定终点(酚酞发生颜色变化)时,溶液pH=8.2~10。
A项:图中a、b两点相比,a点加入NaOH溶液少,剩余HCl浓度大,对水的电离抑制作用大,故水电离出的氢离子浓度:a<b,A项正确;
B项:NaOH溶液与盐酸恰好反应时,溶液pH=7,故0.100 0 mol·L-1 ×20.00 mL=c(HCl)×20.00 mL,c(HCl)=0.100 0mol·L-1,B项错误;
C项:指示剂变色为滴定终点,是一个实验概念,盐酸与NaOH恰好中和时反应物均无剩余,是一个理论概念。两者不完全一致,C项错误;
D项:当滴加NaOH溶液为10.00 mL时,溶液中c(H+)=(0.100 0 mol·L-1 ×20.00 mL-0.100 0 mol·L-1 ×10.00 mL)/(20.00 mL+10.00 mL)=1/30mol·L-1,则溶液pH=1+lg 3,D项正确。
本题选AD。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列表格中各项分类都正确的一组是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | 明矾 | 液态 | 蔗糖 |
B | CaO | 海水 | 铜 | 乙醇 |
C | 胆矾 | 镁合金 | AgCl |
|
D | 氢氧化钠 | 空气 |
| 食醋 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2一种食品添加剂,它致癌。酸性KMnO4溶液与NaNO2的反应方程式是MnO4-+NO2-+![]() →Mn2++NO3-+H2O。下列叙述中正确的是( )
→Mn2++NO3-+H2O。下列叙述中正确的是( )
A.该反应中NO2-被还原
B.反应过程中溶液的pH减小
C.生成1molNaNO3需消耗0.4 mol KMnO4
D.![]() 中的粒子是OH-
中的粒子是OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气的分子数为0.1NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA
C.将含3NA个离子的Na2O2固体溶于水配成1 L溶液,所得溶液中Na+的浓度为2 mol·L-1
D.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.5 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.4 |
A. 反应达到平衡时,X的体积分数为10%
B. 该温度下反应的平衡常数K=16
C. 保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D. 若X、Y的初始浓度均为0.8 mol·L-1,则达到平衡时,W的浓度为0.64 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应,理由是__________。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,醋酸溶液中存在电离平衡:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+) 与0.01 mol·L-1 的醋酸溶液中的c(H+)的比值 ____(填“大于”“小于”或“等于”)10,理由是_________。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是:_____________。
A.c(H+) B.![]() C.c(H+)·c(OH) D.c(OH)/c(H+)
C.c(H+)·c(OH) D.c(OH)/c(H+)
(3)现有pH均为3的醋酸、硫酸两瓶溶液:
①设两种溶液的物质的量浓度依次为c1、c2,则其关系式为_________(用“<”“>”或“=”表示,下同)。
②取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入少量等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式为_______,反应结束放出的氢气的体积依次为V1、V2,则其关系式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述不正确的是( )
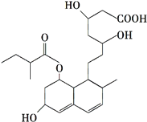
A. 3个—OH皆可因催化氧化生成醛基
B. 能使酸性KMnO4溶液褪色
C. 能发生加成、取代、消去反应
D. 1 mol该物质最多可与2mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 | 电负性 | 熔点 | 酸性 |
O2-____Na+ | N___O | 金刚石_____晶体硅 | 硫酸___高氯酸 |
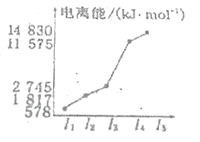
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是(____)
a.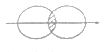 b.
b.![]()
c.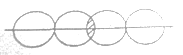 d.
d.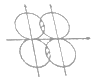
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com