
����Ŀ��һ���¶��£����ܱ�������X��Y��Z��W��������ij�ʼŨ�Ⱥ�ƽ��Ũ�������ʾ������˵������ȷ����
���� | X | Y | Z | W |
��ʼŨ��/mol��L��1 | 0.5 | 0.5 | 0 | 0 |
ƽ��Ũ��/mol��L��1 | 0.1 | 0.1 | 0.4 | 0.4 |
A. ��Ӧ�ﵽƽ��ʱ��X���������Ϊ10%
B. ���¶��·�Ӧ��ƽ�ⳣ��K��16
C. �����¶Ȳ�������ѹǿ����Ӧ���ʼӿ죬ƽ��������Ӧ�����ƶ�
D. ��X��Y�ij�ʼŨ�Ⱦ�Ϊ0.8 mol��L��1����ﵽƽ��ʱ��W��Ũ��Ϊ0.64 mol��L��1
���𰸡�C
��������
�ﵽƽ��״̬�����ʷ�Ӧ��X��Y��Z��W���ʵ���Ϊ0.4��04��0.4��0.4����Ӧ�Ļ�ѧ����ʽΪX+Y![]() Z+W��
Z+W��
A.ƽ����������=![]() ��100%=
��100%=![]() ����ȷ��
����ȷ��
B.ƽ�ⳣ������������ƽ��Ũ����֮�����Է�Ӧ��ƽ��Ũ����֮����K=![]() ����ȷ��
����ȷ��
C.�����������ʵ����ʵ������ڻ�ѧ����ʽ������֮����д��ѧ����ʽΪX+Y![]() Z+W�����ݻ�ѧƽ���ƶ�ԭ������������ѹǿ��Ӧ��������ƽ�ⲻ�ƶ�������
Z+W�����ݻ�ѧƽ���ƶ�ԭ������������ѹǿ��Ӧ��������ƽ�ⲻ�ƶ�������
D.��Ӧǰ������������䣬ͬ����������ʼ����ƽ����ͬ�������ӣ���X��Y�ij�ʼŨ�Ⱦ�Ϊ0.8molL-1����ͬ�����´ﵽƽ�⣬W��Ũ��Ϊ0.64molL-1����ȷ��


 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ���������ʵ��װ����ͼ��ʾ���г�װ������ȥ����

����˵������ȷ���ǣ� ��
A. ˮԡ���ȵ��ŵ�Ϊʹ��Ӧ�����Ⱦ��ȡ��������¶�
B. ��Ũ���ᡢŨ����ͱ����ʱ��Ӧ��Ũ�����м���Ũ���ᣬ����ȴ�����º����û������뱽��
C. ʵ������з�������b��δ�������Ƭ������ȴ��
D. ��Ӧ��ȫ��������a��b����õ���Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ѳ�Ϊ��ʵ��ij��ѧ��ȤС����ʵ������ģ���������̣���Ӧ������������ը��������Ƶ�ģ��װ�����£�

����Ҫ����գ�
��1������F������______________��A�з�Ӧ�����ӷ�Ӧ����ʽ___________________��
��2��Bװ�������ֹ��ܣ��ٿ��������ٶȣ��ھ��Ȼ�������______________________��
��3��Ϊ�˳������������Dװ���е�ʯ�������ȸ���KI��ĩ������Ϊ�ܷɼ�ʯ��______����ܡ����ܡ�����
��4��Eװ�õ�����________��
A.�ռ����� B.�������� C.��ֹ���� D.�����Ȼ���
��5��Eװ���г�������������,�������л���,��E�з�����������ѷ�����_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ҩ��H��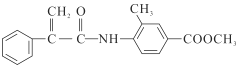 ����һ�ֿ���������������ҩ���ϳ�·����ͼ��ʾ��
����һ�ֿ���������������ҩ���ϳ�·����ͼ��ʾ��

��֪��
��1��E�ķ���ʽΪC9H8O2����ʹ������Ȼ�̼��Һ��ɫ��
��2��RCOOH![]()
![]() ��
��
��3��![]() +R1NH2
+R1NH2![]()
![]() +HBr��������R��R1��������
+HBr��������R��R1��������
��ش��������⣺
��1��A�Ľṹ��ʽΪ___________��E�Ĺ����ŵ�����Ϊ___________��
��2���ٵķ�Ӧ������________���ܵķ�Ӧ������__________��
��3��д��C��D�Ļ�ѧ����ʽ��______________________��
��4��д��F+G��H�Ļ�ѧ����ʽ��_________________________________________��
��5��E�ж���ͬ���칹�壬ͬʱ��������������E��ͬ���칹����____������˳���칹���֡�
i.�ܷ���������Ӧ��
ii.�ܷ���ˮ�ⷴӦ��
iii.�����к��Ļ�ֻ�б�����
��6������H�������ϳ�·�ߣ����һ������ȩ��NH2CH(CH3)2Ϊ��ʼԭ���Ʊ�ҽҩ�м���CH3CONHCH(CH3)2�ĺϳ�·��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̫���ܵ�����Ա���Ϳ����(Rii)��������TiO2����Ⱦ�ϵ������粣���Ͷ�Pt���粣��Ϊ���塣�乤��ԭ������ͼ��ʾ��

���й��ڸõ��������ȷ����
A. ��ع���ʱ�����ɹ���ֱ��ת�����������漰��ѧ��ת��
B. ��ع������ܷ�ӦΪ��RuII+I3-=RuIII+3I-
C. ��̫�����������Ⱦ��ʱ������Ⱦ�����ڵ缫�ĵ��Ƶ��ڶ�Pt���粣���缫
D. ��ع���ʱ��Ϊ�������磬��Ҫ���ڲ����йص����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֪����ʱ��0.1 mol/LijһԪ��HA��ˮ����0.1%�������룬�ش��������⣺
(1)����Һ��c(H��)��___________��
(2)HA�ĵ���ƽ�ⳣ��K��______________��
(3)��HA�������c(H��)ԼΪˮ�������c(H��)��________����
�������£���һpH = 12��NaOH��Һ100 mL ����ʹ����pH��Ϊ11��
(1)�����������ˮ���ͼ���__________mL
(2)�������pH = 10��NaOH��Һ��Ӧ����_________ mL
(3)�������0.008 mol/L HCl��Һ��Ӧ����___________ mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100mLij���������Ļ����Һ�ֳ����ȷݡ�һ�ݼ������BaCl2��Һ����ַ�Ӧ��ó���2.33g����һ�ݼ���50mL1.0mol��L-1NaOH��Һ����ַ�Ӧ����Һ�� c(OH-)=0.1mol��L-1����Ӧ����Һ�����Ϊ100mL�����Լ��㣺
��1��ÿ����Һ������H2SO4�����ʵ���______________mol��
��2��ԭ�����Һ����������ʵ���Ũ��_____________mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�羮��ȱ����þ����ȱ�ٵ��Ƿ�����þ�������硣��ˮ��þ�ľ��Ժ����ߵ����Ũ��ȴС[c��Mg2+��ԼΪ0.054mo1L��1]����ҵ�ϳ��Ӻ�ˮ����þ�����������̵����۷�����ͼ��ʾ��

��1��Ҫʵ�ֶԺ�ˮ��þԪ�صĸ�����һ���ȡ______�����ţ�����ֱ������ˮ�м����������������ɹ�κ�Ŀ�±ˮ�������м�������������ȼ���������ˮ���ټ��������
��2�����ݱ���4���Լ����г��۸����ݣ�ѡ��_____����������������������þ�������ͽ��ں��ߣ�____�����������Լ������ԭ�ϡ�
�Լ� | NaOH | KOH | Ca��OH��2 | Ba��OH��2 |
�۸�Ԫ/�֣� | 3300 | 9500 | 580 | 3500 |
��3�������±���3�ֵ���ʵ��۵����ݣ���ͼ�����У�����______���ţ��˷�����ȡ�������̬����ʶ����ǵ����ˮ��Һ��ԭ����______�����Ļ�ѧ����ʽΪ_____��
����� | MgCl2 | MgO | MgSO4 |
�۵�/�� | 714 | 2800 | 1327 |
��4��������õ�þ������ȴ��Ϊ����þ����ȴþ��������ѡ��_______��Χ��
A��N2 B��CO2 C��Ar D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����Ԫ�صķǽ����Ա���Ԫ��ǿ���ǣ� ��
A. �ܽ��ԣ�HCl > H2SB. Cl2+H2S��2HCl+S
C. �ȶ��ԣ� HCl > H2SD. 3Cl2+2Fe![]() 2FeCl3��S+Fe
2FeCl3��S+Fe![]() FeS
FeS
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com