
【题目】自然界井不缺少“镁”,缺少的是发现“镁”的眼晴。海水中镁的绝对含量高但相对浓度却小[c(Mg2+)约为0.054mo1L﹣1]。工业上常从海水中提镁,其生产过程的讨论方案如图所示:

(1)要实现对海水中镁元素的富集,一般采取______(填编号)。①直接往海水中加入沉淀剂;②利用晒盐后的苦卤水,向其中加入沉淀剂;③先加热蒸发海水,再加入沉淀剂
(2)根据表中4种试剂的市场价格数据,选择_____做沉淀剂最合理,如果“提镁”工厂就建在海边,____是生产这种试剂的最好原料。
试剂 | NaOH | KOH | Ca(OH)2 | Ba(OH)2 |
价格(元/吨) | 3300 | 9500 | 580 | 3500 |
(3)根据下表中3种电解质的熔点数据,上图方案中,方案______最优,此方案采取电解熔融态电解质而不是电解其水溶液,原因是______;电解的化学方程式为_____。
电解质 | MgCl2 | MgO | MgSO4 |
熔点/℃ | 714 | 2800 | 1327 |
(4)电解所得的镁蒸气冷却后即为固体镁,冷却镁蒸气可以选择_______氛围。
A、N2 B、CO2 C.Ar D.空气
【答案】② Ca(OH)2 贝壳 1 金属镁活泼性强,会与水反应,电解溶液得不到镁单质 MgCl2![]() Mg+Cl2↑ C
Mg+Cl2↑ C
【解析】
(1)要实现对海水中镁元素的富集,一般采取的方法为先沉淀后溶解沉淀,即利用晒盐后的苦卤水,向其中加入沉淀剂,故答案选②;
(2)根据表中4种试剂的市场价格数据,选择氢氧化钙做沉淀剂最合理,因为其成本最低,如果“提镁”工厂就建在海边,可灼烧贝壳(主要成分为碳酸钙),来获取氢氧化钙;
(3)根据表中3种电解质的熔点数据,氯化镁的熔点最低,故使其熔融所耗能量最少,方案1最优,方案采取电解熔融态电解质而不是电解其水溶液,原因是金属镁活泼性强,会与水反应,电解溶液得不到镁单质,电解的方程式为MgCl2![]() Mg+Cl2↑;
Mg+Cl2↑;
(4)电解所得的镁蒸气冷却后即为固体镁,冷却镁蒸气可以选择在惰性气体Ar气氛围中,原因是金属Mg在高温下会和氮气、二氧化碳、空气发生化学反应。


科目:高中化学 来源: 题型:
【题目】汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是
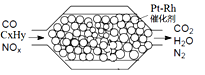
A. 尾气造成“雾霾”与汽油未充分燃烧有关
B. 尾气处理过程,氮氧化物(NOX)被还原
C. Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D. 使用氢氧燃料电池作汽车动力能有效控制雾霾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.5 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.4 |
A. 反应达到平衡时,X的体积分数为10%
B. 该温度下反应的平衡常数K=16
C. 保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D. 若X、Y的初始浓度均为0.8 mol·L-1,则达到平衡时,W的浓度为0.64 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。10.1g该样品与50mL1mol/L硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A. 78B. 140C. 156D. 172
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某种酶生物燃料电池的工作原理示意图。下列说法中不正确的是

A. 葡萄糖是还原剂
B. 外电路中电子由A极移向B极
C. 溶液中H+ 由B极区移向A极区
D. B极电极反应式为:H2O2 +2H++2e-=== 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2O4(g)![]() 2NO2(g) ΔH=+57.20 kJ/mol,t℃时,将一定量的NO2、N2O4充入一个容积为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) ΔH=+57.20 kJ/mol,t℃时,将一定量的NO2、N2O4充入一个容积为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
下列推断不正确的是
A. c(X)代表NO2的浓度
B. 20min时改变的条件是向容器中加入0.8molNO2
C. 该反应的平衡常数K=0.9 mol/L
D. 25min后混合气体的平均摩尔质量为64.4g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________,Fe3+的基态价电子排布图为___________。
(2)在上述两种钾盐中第一电离能最大的元素为___________,电负性最小的元素为___________。
(3)H2C2O4分子屮碳原子的杂化类型是___________,与C2O42-互为等电子体的分子的化学式为___________(写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________(用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
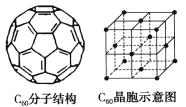
①1个C60分子中含有π键的数目为___________。
②晶胞中C60的配位数为___________。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________g·cm-3(NA代表阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A(g) + B(g) ![]() mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )
mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )

A. T1 < T2
B. 正反应是放热反应
C. m<2
D. 恒温、恒容充入稀有气体,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com