
【题目】在一定条件下,可逆反应A(g) + B(g) ![]() mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )
mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )

A. T1 < T2
B. 正反应是放热反应
C. m<2
D. 恒温、恒容充入稀有气体,平衡逆向移动
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某新型药物H(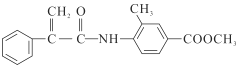 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:
(1)E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色;
(2)RCOOH![]()
![]() ;
;
(3)![]() +R1NH2
+R1NH2![]()
![]() +HBr。(以上R,R1均为烃基)
+HBr。(以上R,R1均为烃基)
请回答下列问题:
(1)A的结构简式为___________;E的官能团的名称为___________。
(2)①的反应类型是________;④的反应条件是__________。
(3)写出C→D的化学方程式:______________________。
(4)写出F+G→H的化学方程式:_________________________________________。
(5)E有多种同分异构体,同时满足下列条件的E的同分异构体有____(考虑顺反异构)种。
i.能发生银镜反应;
ii.能发生水解反应;
iii.分子中含的环只有苯环。
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界井不缺少“镁”,缺少的是发现“镁”的眼晴。海水中镁的绝对含量高但相对浓度却小[c(Mg2+)约为0.054mo1L﹣1]。工业上常从海水中提镁,其生产过程的讨论方案如图所示:

(1)要实现对海水中镁元素的富集,一般采取______(填编号)。①直接往海水中加入沉淀剂;②利用晒盐后的苦卤水,向其中加入沉淀剂;③先加热蒸发海水,再加入沉淀剂
(2)根据表中4种试剂的市场价格数据,选择_____做沉淀剂最合理,如果“提镁”工厂就建在海边,____是生产这种试剂的最好原料。
试剂 | NaOH | KOH | Ca(OH)2 | Ba(OH)2 |
价格(元/吨) | 3300 | 9500 | 580 | 3500 |
(3)根据下表中3种电解质的熔点数据,上图方案中,方案______最优,此方案采取电解熔融态电解质而不是电解其水溶液,原因是______;电解的化学方程式为_____。
电解质 | MgCl2 | MgO | MgSO4 |
熔点/℃ | 714 | 2800 | 1327 |
(4)电解所得的镁蒸气冷却后即为固体镁,冷却镁蒸气可以选择_______氛围。
A、N2 B、CO2 C.Ar D.空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有封闭体系如下图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是____________

A.第一次平衡时,SO2的物质的量右室更多
B.通入气体未反应前,左室压强和右室一样大
C.第一次平衡时,左室内压强一定小于右室
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
(2)有封闭体系如图所示,甲、乙之间的隔板K和活塞F都可左右移动,先用小钉固定隔板K在如图位置(0处),甲中充入1molN2和3molH2,乙中充入2molNH3和1molAr,此时F处于如图6处。拔取固定K的小钉,在少量固体催化剂作用下发生可逆反应:N2(g)+ 3H2(g)![]() 2 NH3(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2 NH3(g); 反应达到平衡后,再恢复至原温度。回答下列问题:

① 达到平衡时,移动活塞F最终仍停留在0刻度右侧6处,则K板位置范围是________。
② 若达到平衡时,隔板K最终停留在0刻度处,则甲中NH3的物质的量为______mol, 此时,乙中可移动活塞F最终停留在右侧刻度____处(填下列序号:①>8; ②<8; ③=8)
③ 若一开始就将K、F都固定,其它条件均不变,则达到平衡时测得甲中H2的转化率为b,则乙中NH3的转化率为_________;假设乙、甲两容器中的压强比用d表示,则d的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。下列说法不正确的是
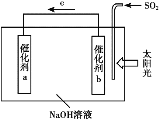
A. 该装置可将太阳能转化为化学能
B. 催化剂a表面发生还原反应,产生H2
C. 催化剂b附近的溶液pH增大
D. 吸收1 mol SO2,理论上能产生1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明氯元素的非金属性比硫元素强的是( )
A. 溶解性:HCl > H2SB. Cl2+H2S→2HCl+S
C. 稳定性: HCl > H2SD. 3Cl2+2Fe![]() 2FeCl3、S+Fe
2FeCl3、S+Fe![]() FeS
FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药丹参中存在丹参醇。一种人工合成丹参醇的部分路线如下:

已知:![]()
完成下列填空:
(1)A中官能团的名称:__________________。
(2)D→E的反应条件:___________________。
(3)A和B生成C的反应类型是:______反应。
(4)在铜做催化剂、加热条件下,1mol丹参醇能被_____molO2氧化。
(5)B的分子式是:C9H6O3。符合下列条件的B的同分异构体有__种,写出其中能发生银镜反应的同分异构体的结构简式_____。
①苯环上直接连有一个—OH
②—OH对位上还有一个侧链,该侧链含:—C![]() C—、—COO—。
C—、—COO—。
(6)利用已知条件,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲
的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲![]() 乙
乙![]()
![]() 目标产物)。_____________
目标产物)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸吡酮洛芬(H)是一种消炎镇痛药,其合成路线如下:

已知R-CN![]() R-COOH
R-COOH
回答下列问题:
(1)A的化学名称是____。
(2)由B生成C的化学方程式为________。
(3)D的结构简式为_______。
(4)F中官能团的名称为_____。
(5)G生成H(试剂X的分子式为C6H8N2)的反应类型是____。
(6)E的分子式为____。X与E互为同分异构体,X的分子中含两个苯环,X水解后产物之一既能发生银镜反应又能与FeCl3溶液发生显色反应,X的核磁共振氢谱显示有6种不同化学环境的氢,峰面积之比为1:2:2:2:2:3。写出符合条件的X的结构简式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com