
【题目】(1)有封闭体系如下图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是____________

A.第一次平衡时,SO2的物质的量右室更多
B.通入气体未反应前,左室压强和右室一样大
C.第一次平衡时,左室内压强一定小于右室
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
(2)有封闭体系如图所示,甲、乙之间的隔板K和活塞F都可左右移动,先用小钉固定隔板K在如图位置(0处),甲中充入1molN2和3molH2,乙中充入2molNH3和1molAr,此时F处于如图6处。拔取固定K的小钉,在少量固体催化剂作用下发生可逆反应:N2(g)+ 3H2(g)![]() 2 NH3(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2 NH3(g); 反应达到平衡后,再恢复至原温度。回答下列问题:

① 达到平衡时,移动活塞F最终仍停留在0刻度右侧6处,则K板位置范围是________。
② 若达到平衡时,隔板K最终停留在0刻度处,则甲中NH3的物质的量为______mol, 此时,乙中可移动活塞F最终停留在右侧刻度____处(填下列序号:①>8; ②<8; ③=8)
③ 若一开始就将K、F都固定,其它条件均不变,则达到平衡时测得甲中H2的转化率为b,则乙中NH3的转化率为_________;假设乙、甲两容器中的压强比用d表示,则d的取值范围是_______________。
【答案】BC 0刻度左侧0-2处 1 ① 1-b 5/4<d< 3/2
【解析】
(1)A. 根据2SO2 + O2 ![]() 2SO3,把2molSO3导入左边相当于2molSO2, 1molO2,而左室体积大于右室,左室相对右室相当于减小压强,平衡左移;
2SO3,把2molSO3导入左边相当于2molSO2, 1molO2,而左室体积大于右室,左室相对右室相当于减小压强,平衡左移;
B. 根据PV=nRT,左室气体物质的量和体积均是右室的2倍,即压强相等;
C. 根据2SO2 + O2 ![]() 2SO3,把2molSO3导入左边相当于2molSO2 ,1molO2 ,而左室体积大于右室,左室相对右室相当于减小压强,平衡左移;
2SO3,把2molSO3导入左边相当于2molSO2 ,1molO2 ,而左室体积大于右室,左室相对右室相当于减小压强,平衡左移;
D. 第二次平衡时,气体体积变为左室体积的1.5倍,把2molSO3导入左边相当于2molSO2 ,1molO2 ,物质的量变为2倍,比第一次平衡时压强变大,平衡正向移动。
(2)①当乙中没有Ar气时,甲中充入1molN2和3molH2与乙中充入2molNH3到达平衡状态时,为等效的,即两边气体的物质的量相等,隔板应位于中间0处,此后向乙中再充入1molAr气,会使乙中气体压强增大,隔板向甲的方向移动,会使甲中的反应向正向移动。
②根据题中条件,当达到平衡时,K停留在0处,说明乙端的相当有8个格。
③体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氩气对平衡无影响;体积不变,两边转化结果相同,H2的转化率为b,则乙中NH3的转化率为1-b;此题仍要考虑两种极限情况,即乙、甲完全转化与乙、甲完全不转化。
(1)A. 根据2SO2 + O2 ![]() 2SO3,把2molSO3导入左边相当于2molSO2, 1molO2,而左室体积大于右室,左室相对右室相当于减小压强,平衡左移 ,生成的SO2的物质的量更多,故A错误。
2SO3,把2molSO3导入左边相当于2molSO2, 1molO2,而左室体积大于右室,左室相对右室相当于减小压强,平衡左移 ,生成的SO2的物质的量更多,故A错误。
B.根据PV=nRT,左室气体物质的量和体积均是右室的2倍,即压强相等,故B正确。
C. 根据2SO2 + O2 ![]() 2SO3,把2molSO3导入左边相当于2molSO2 ,1molO2 ,而左室体积大于右室,左室相对右室相当于减小压强,平衡左移,故左室内压强一定小于右室,故C正确。
2SO3,把2molSO3导入左边相当于2molSO2 ,1molO2 ,而左室体积大于右室,左室相对右室相当于减小压强,平衡左移,故左室内压强一定小于右室,故C正确。
D. 第二次平衡时,气体体积变为左室体积的1.5倍,把2molSO3导入左边相当于2molSO2 ,1molO2 ,物质的量变为2倍,比第一次平衡时压强变大,平衡正向移动,生成的SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍少,故D错误。
故选BC。
(2)① 当乙中没有Ar气时,甲中充入1molN2和3molH2与乙中充入2molNH3到达平衡状
态时,为等效的,即两边气体的物质的量相等,隔板应位于中间0处,此后向乙中再充
入1molAr气,会使乙中气体压强增大,隔板向甲的方向移动,会使甲中的反应向正向
移动,再次到达平衡时,隔板位于0刻度左侧左处,通过观察,当反应未开始时隔板位于0处,每一个格相当于0.5mol气体,假设隔板K最终在a处,设甲中反应到达平衡时,有xmolN2发生反应
N2(g)+ 3H2(g)![]() 2 NH3(g)
2 NH3(g)
开始(mol) 1mol 3mol 0
转化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
(1-x)+ (3-3x)+ 2x=(6-a) ×0.5a,0.5a=2x-1,当N2完全反应时,x=1,a取最大,a=2,根据可逆反应不能进行到底,可知:K停留在0刻度左侧0-2处,故答案为:0刻度左侧0-2处。
②根据题中条件,当达到平衡时,K停留在0处,说明乙端的相当有8个格,即乙中平衡时气体的物质的量为4mol,其中Ar为1mol,设乙中达到平衡时有2ymol NH3反应,
2NH3(g) ![]() N2(g)+ 3H2(g)
N2(g)+ 3H2(g)
开始(mol) 2mol 0 0
转化(mol) 2y y 3y
平衡(mol) 2-2y y 3y
2-2y +y + 3y=3,2y=1,甲中NH3的物质的量为1mol;
根据题中信息可知,甲和乙是在恒温恒压条件下的反应,属于等效平衡,若平衡时K停留在0处,说明甲中平衡混合物为4mol,如乙平衡不移动,乙中为NH3和Ar,共3mol, 体积为8,故答案为:1;①。
③体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氩气对平衡无影响;体积不变,两边转化结果相同,H2的转化率为b,则乙中NH3的转化率为1-b;此题仍要考虑两种极限情况,即乙、甲完全转化与乙、甲完全不转化,当乙完全不转化、甲完全转化时,恒容,d=P(乙)/ P(甲)=3/2, 当乙完全转化、甲完全不转化时,恒容,d=P(乙)/ P(甲)= 5/4,故答案为:1-b ; 5/4<d< 3/2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示:

下列说法正确的是
A. 该反应的△H<0
B. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时,v(正)>v(逆)
C. X点与Y点容器内压强比为51:55
D. X点CH4的转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。10.1g该样品与50mL1mol/L硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A. 78B. 140C. 156D. 172
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2O4(g)![]() 2NO2(g) ΔH=+57.20 kJ/mol,t℃时,将一定量的NO2、N2O4充入一个容积为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) ΔH=+57.20 kJ/mol,t℃时,将一定量的NO2、N2O4充入一个容积为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
下列推断不正确的是
A. c(X)代表NO2的浓度
B. 20min时改变的条件是向容器中加入0.8molNO2
C. 该反应的平衡常数K=0.9 mol/L
D. 25min后混合气体的平均摩尔质量为64.4g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________,Fe3+的基态价电子排布图为___________。
(2)在上述两种钾盐中第一电离能最大的元素为___________,电负性最小的元素为___________。
(3)H2C2O4分子屮碳原子的杂化类型是___________,与C2O42-互为等电子体的分子的化学式为___________(写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________(用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
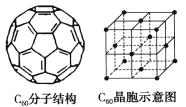
①1个C60分子中含有π键的数目为___________。
②晶胞中C60的配位数为___________。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________g·cm-3(NA代表阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带活塞的密闭容器中,当反应2NO2(g) ![]() N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是( )
N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是( )
A. 升高温度,气体颜色加深,则此正反应为吸热反应
B. 慢慢压缩气体体积,平衡向右移动,混合气体颜色较原来深
C. 慢慢压缩气体使体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入惰性气体,压强增大,平衡不会移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A(g) + B(g) ![]() mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )
mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )

A. T1 < T2
B. 正反应是放热反应
C. m<2
D. 恒温、恒容充入稀有气体,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的是
A. 开启汽水瓶后,瓶中马上泛起大量泡沫
B. Cl2(HCl)要除去其中的HCl,将其通过饱和食盐水
C. 在N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0 中,反应条件是高温、高压催化剂
2NH3(g) ΔH<0 中,反应条件是高温、高压催化剂
D. SO2催化氧化成SO3的反应,往往需要使用过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molHClO中所含H—Cl键的数目为NA
B. 8.8g乙酸乙酯中所含碳原子数为0.4NA
C. 1.2gC与0.1molCO2在高温下充分反应生成的CO分子数为0.1NA
D. 标准状况下,1L0.1mol·L-1HCl溶液中滴加氨水至pH=7,溶液中![]() 的数目为0.1NA
的数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com