
【题目】[化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________,Fe3+的基态价电子排布图为___________。
(2)在上述两种钾盐中第一电离能最大的元素为___________,电负性最小的元素为___________。
(3)H2C2O4分子屮碳原子的杂化类型是___________,与C2O42-互为等电子体的分子的化学式为___________(写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________(用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
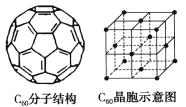
①1个C60分子中含有π键的数目为___________。
②晶胞中C60的配位数为___________。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________g·cm-3(NA代表阿伏加德罗常数)。
【答案】![]() 第四周期 Ⅷ N K sp2 N2O4 2Fe3++2I-=2Fe2++I2 30 12
第四周期 Ⅷ N K sp2 N2O4 2Fe3++2I-=2Fe2++I2 30 12 ![]()
【解析】
(1)铁是26号元素,核外电子排布为2、8、14、2,所以Fe元素在周期表中位置为第四周期第VIII族,Fe3+的核外电子排布为2、8、13,其基态价电子排布图为![]() ;
;
(2)一般情况下,元素的非金属性越强,其从第一电离能就越大,在上述两种钾盐中含有的元素有K、Fe、C、N、O、H,非金属性最强的元素的O元素,但由于N原子的最外层电子处于2p轨道的半充满状态,比较稳定,失去电子比相邻的O元素难,所以两种钾盐中第一电离能最大的元素为N元素;金属性最强的元素的K,故电负性最小的元素为K元素;
(3)在H2C2O4分子中,两个碳原子与O原子形成了碳氧双键,两个碳原子形成了碳碳双键,还与羟基氧原子形成了碳氧单键,所以C的杂化类型是sp2杂化;根据等电子体的概念及C2O42-的构成原子个数、含有的电子数,可知与C2O42-互为等电子体的分子的化学式为N2O4;
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是Fe3+具有强氧化性,I-具有还原性,二者会发生反应:2Fe3++2I-= 2Fe2++I2,所以F-常用于Fe3+的掩蔽剂,而I-不可以;
(5) ①每个碳原子形成1个π键,每π键为2个碳原子共有,则一个C60分子中含有π键个数为(1×60)÷2=30;
②根据晶胞结构示意图可知:C60分子处于晶胞顶点、面心位置,以C60顶点为研究,与之最近的C60分子处于面心,每个顶点为8个晶胞共用,每个面为2个晶胞共用,与每个C60分子距离最近且相等的C60分子有![]() =12个;
=12个;
③晶胞中C60分子数目=8×![]() +6×
+6×![]() =4,晶胞质量m=
=4,晶胞质量m=![]() g,则晶胞的密度
g,则晶胞的密度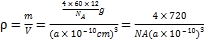 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓慢不发生爆炸),其设计的模拟装置如下:

根据要求填空:
(1)仪器F的名称______________;A中反应的离子反应方程式___________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体③______________________。
(3)为了除多余的氯气,D装置中的石棉网均匀附着KI粉末,你认为能否换成碱石灰______(填“能”或“不能”)。
(4)E装置的作用________。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)E装置中除了盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将100mL某盐酸和硫酸的混合溶液分成两等份。一份加入过量BaCl2溶液,充分反应后得沉淀2.33g;另一份加入50mL1.0mol·L-1NaOH溶液,充分反应后溶液的 c(OH-)=0.1mol·L-1(反应后溶液的体积为100mL)。试计算:
(1)每份溶液中所含H2SO4的物质的量______________mol。
(2)原混合溶液中盐酸的物质的量浓度_____________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界井不缺少“镁”,缺少的是发现“镁”的眼晴。海水中镁的绝对含量高但相对浓度却小[c(Mg2+)约为0.054mo1L﹣1]。工业上常从海水中提镁,其生产过程的讨论方案如图所示:

(1)要实现对海水中镁元素的富集,一般采取______(填编号)。①直接往海水中加入沉淀剂;②利用晒盐后的苦卤水,向其中加入沉淀剂;③先加热蒸发海水,再加入沉淀剂
(2)根据表中4种试剂的市场价格数据,选择_____做沉淀剂最合理,如果“提镁”工厂就建在海边,____是生产这种试剂的最好原料。
试剂 | NaOH | KOH | Ca(OH)2 | Ba(OH)2 |
价格(元/吨) | 3300 | 9500 | 580 | 3500 |
(3)根据下表中3种电解质的熔点数据,上图方案中,方案______最优,此方案采取电解熔融态电解质而不是电解其水溶液,原因是______;电解的化学方程式为_____。
电解质 | MgCl2 | MgO | MgSO4 |
熔点/℃ | 714 | 2800 | 1327 |
(4)电解所得的镁蒸气冷却后即为固体镁,冷却镁蒸气可以选择_______氛围。
A、N2 B、CO2 C.Ar D.空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g) ②2M(g)
2Z(g) ②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

反应开始 平衡(I) 平衡(II)
下列判断正确的是
A. 达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11
B. 反应①的正反应是吸热反应
C. 在平衡(I)和平衡(II)中,M的体积分数相等
D. 达平衡(I)时,X的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有封闭体系如下图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是____________

A.第一次平衡时,SO2的物质的量右室更多
B.通入气体未反应前,左室压强和右室一样大
C.第一次平衡时,左室内压强一定小于右室
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
(2)有封闭体系如图所示,甲、乙之间的隔板K和活塞F都可左右移动,先用小钉固定隔板K在如图位置(0处),甲中充入1molN2和3molH2,乙中充入2molNH3和1molAr,此时F处于如图6处。拔取固定K的小钉,在少量固体催化剂作用下发生可逆反应:N2(g)+ 3H2(g)![]() 2 NH3(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2 NH3(g); 反应达到平衡后,再恢复至原温度。回答下列问题:

① 达到平衡时,移动活塞F最终仍停留在0刻度右侧6处,则K板位置范围是________。
② 若达到平衡时,隔板K最终停留在0刻度处,则甲中NH3的物质的量为______mol, 此时,乙中可移动活塞F最终停留在右侧刻度____处(填下列序号:①>8; ②<8; ③=8)
③ 若一开始就将K、F都固定,其它条件均不变,则达到平衡时测得甲中H2的转化率为b,则乙中NH3的转化率为_________;假设乙、甲两容器中的压强比用d表示,则d的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。下列说法不正确的是
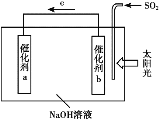
A. 该装置可将太阳能转化为化学能
B. 催化剂a表面发生还原反应,产生H2
C. 催化剂b附近的溶液pH增大
D. 吸收1 mol SO2,理论上能产生1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明氯元素的非金属性比硫元素强的是( )
A. 溶解性:HCl > H2SB. Cl2+H2S→2HCl+S
C. 稳定性: HCl > H2SD. 3Cl2+2Fe![]() 2FeCl3、S+Fe
2FeCl3、S+Fe![]() FeS
FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个氯气分子的物质的量是________,氯原子的物质的量是________。
(2)1.5molNa2SO4·10H2O中所含的Na+的物质的量是________,所含的SO42-的物质的量是________,所含H2O的数目是______。
(3)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为______。
(4)12.4gNa2R含0.4molNa+,则Na2R的摩尔质量为_____,R的相对原子质量为________。含R的质量为1.6g的Na2R,其物质的量为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com