
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g) ②2M(g)
2Z(g) ②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

反应开始 平衡(I) 平衡(II)
下列判断正确的是
A. 达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11
B. 反应①的正反应是吸热反应
C. 在平衡(I)和平衡(II)中,M的体积分数相等
D. 达平衡(I)时,X的转化率为50%
【答案】A
【解析】
A、平衡时,右边物质的量不变,由图可以看出达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为:![]() =
=![]() ,故A正确;
,故A正确;
B、降温由平衡(Ⅰ)向平衡(Ⅱ)移动,同时X、Y、Z的总物质的量减少,说明平衡向右移动,正反应放热,故B错误;
C、由平衡(Ⅰ)到平衡(Ⅱ),化学反应②发生移动,M的体积分数不会相等的,故C错误;
D、达平衡(Ⅰ)时,右边气体的物质的量不变,仍为2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,
X(g)+2Y(g)![]() 2Z(g)
2Z(g)
起始(mol) 1 2 0
转化(mol) ![]() 2
2![]() 2
2![]()
平衡(mol) 1-![]() 2-2
2-2![]() 2
2![]()
则有:![]() =
=![]() ,x=
,x=![]() =
=![]() mol,即1-
mol,即1-![]() + 2-2
+ 2-2![]() + 2
+ 2![]() =
=![]() ,
,![]() =
=![]() ,
,
所以达平衡(Ⅰ)时,X的转化率为![]() ,故D错误。
,故D错误。
故选A。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】1-丙醇和乙酸在浓硫酸作用下,反应制得乙酸丙酯,反应温度为115125℃,反应 装置如图。下列对该实验描述错误的是

A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 通常加入过量1—丙醇以提高乙酸的转化率
D. 提纯乙酸丙酯,可用水和氢氧化钠溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,用化学用语回答下列有关问题。

(1)其中属于阴离子的是_____;
(2)其中化学性质最稳定的是_____;
(3)已知A元素的某种核素的中子数为18,该核素的符号是_____;
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,该元素的离子结构示意图为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某种酶生物燃料电池的工作原理示意图。下列说法中不正确的是

A. 葡萄糖是还原剂
B. 外电路中电子由A极移向B极
C. 溶液中H+ 由B极区移向A极区
D. B极电极反应式为:H2O2 +2H++2e-=== 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为常见的有机物,它们之间有如下转化关系。已知:①A是一种植物生长调节剂,有催熟作用;②醛基在氧气中易被氧化成羧基。回答下列问题: 
(1)A和B中官能团名称分别是___和___。
(2)在F的众多同系物中:最简单的同系物其空间构型为___;含5个碳原子的同系物其同分异构体有___种,其中一氯代物种类最少的同系物的结构简式为___。
(3)反应⑥和⑦均可得到G,要制备得到较纯净的G,应该选用反应_____。
(4)反应①﹣⑦属取代反应的有___;反应④中,浓硫酸的作用是___。反应②的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________,Fe3+的基态价电子排布图为___________。
(2)在上述两种钾盐中第一电离能最大的元素为___________,电负性最小的元素为___________。
(3)H2C2O4分子屮碳原子的杂化类型是___________,与C2O42-互为等电子体的分子的化学式为___________(写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________(用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
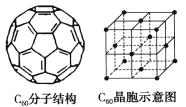
①1个C60分子中含有π键的数目为___________。
②晶胞中C60的配位数为___________。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________g·cm-3(NA代表阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的“蓝鲸一号”在中国南海神狐海域完成可燃冰连续试采,并得到中共中央国务院公开致电祝贺。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是_______________________________(回答一条即可)。
(2)甲烷自热重整是一种先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+ | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158. 6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。

该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和环境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。

①过程II中第二步反应的化学方程式为_________。
②过程II的催化剂是______,只有过程I投料比![]() _______,催化剂组成才会保持不变。
_______,催化剂组成才会保持不变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气是重要的化工原料,主要用作化肥、冷冻剂等。现向一固定容积的反应器中通入2molN2和6molH2在催化剂作用下加热至平衡状态,测得此时容器内压强比反应前减小了![]() ,列式计算H2的平衡转化率___。
,列式计算H2的平衡转化率___。
(2)燃料的燃烧将化学能转化成热能,提供了人类生存和发展所需要的能量和动力。现将标况下8.96L乙烷和乙烯的混合气体和足量氧气充分混合并点燃,燃烧产物经过浓硫酸充分吸收后增重16.2g,则混合气体中乙烷和乙烯的物质的量之比为多少___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素①X、Y、Z的单质在常温下均为气体;②X单质可以在Z单质中燃烧,生成物为XZ,其中火焰为苍白色;③XZ极易溶于水,电离出X+和Z﹣,其水溶液可使蓝色石蕊试液变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中所得溶液具有漂白作用。
(1)推断元素符号X_____、Y_____、Z_____;
(2)化合物XZ的电子式为_____,X2Y属于_____(填离子化合物、共价化合物、共价分子);
(3)写出XZ(写化学式)的电离方程式_____;写出XZ(写化学式)与Ca(ClO)2反应的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com