
����Ŀ���ҹ������з��ġ�����һ�š����й��Ϻ����������ɿ�ȼ�������Բɣ����õ��й��������Ժ�����µ�ף�ء�����ȼ��������Ȼ��ˮ�������������ڳ��³�ѹ��Ѹ�ٷֽ��ͷų����飬����Ϊδ������Դ��
��1������ȼ������Ϊ��Դ���ŵ���_______________________________(�ش�һ������)��
��2����������������һ���Ƚ������ⷽ��,�����������������������������̡���Ӧϵͳͬʱͨ����顢������ˮ����,��������Ҫ��ѧ��Ӧ����:
��Ӧ���� | ��ѧ����ʽ | �ʱ��H(kJ.mol-l) | ���E.(kJ.mol-1) |
�������� | CH4(g)+ | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
�������� | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158. 6 | 243.9 |
�ش���������:
���ڳ�ʼ�Σ��������������ķ�Ӧ����______(����ڡ���С�ڡ����ڡ�)���������ķ�Ӧ���ʡ�
�ڷ�ӦCH4(g)+H2O(g)![]() CO(g)+3H2(g)��ƽ��ת�������¶ȡ�ѹǿ��ϵ[����n(CH4)��n(H2O)=1:1]��ͼ��ʾ��
CO(g)+3H2(g)��ƽ��ת�������¶ȡ�ѹǿ��ϵ[����n(CH4)��n(H2O)=1:1]��ͼ��ʾ��

�÷�Ӧ��ͼ��A���ƽ�ⳣ��Kp=________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��ͼ��ѹǿ(p1��p2��p3��p4)�ɴ�С��˳��Ϊ___________��
�۴������Ƕȷ������������������������Ƚ�֮������___________��
��3�����鳬������CO2�����ɵõ�����CO�����壬����Դ�ͻ����ϵ�˫�������ش��鳬������CO2�Ĵ�ת��ԭ����ͼ��ʾ��

�ٹ���II�еڶ�����Ӧ�Ļ�ѧ����ʽΪ_________��
�ڹ���II�Ĵ�����______��ֻ�й���IͶ�ϱ�![]() _______��������ɲŻᱣ�ֲ��䡣
_______��������ɲŻᱣ�ֲ��䡣
���𰸡������ܶȸߡ���ࡢ��ȾС�������� С�� 3/16(Mpa)2��0.1875( Mpa)2 p1>p2>p3>p4 ����������Ӧ�ų�����������������������Ӧ���������������ﵽ����ƽ�� 3Fe+4CaCO3![]() Fe3O4+4CaO+4CO�� Fe3O4��CaO 1/3
Fe3O4+4CaO+4CO�� Fe3O4��CaO 1/3
��������
��1������ȼ������һ�ְ�ɫ���壬�м�ǿ��ȼ������
��2���ٴӱ��л�����ݿ����ڳ�ʼ�Σ���������������Ӧ��ܽϴ����������ķ�Ӧ��ܾ���С�����Լ��������ķ�Ӧ���ʿ졣
�ڼ��������1mol��ˮ������1mol��
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼ�� 1 1 0 0
�仯�� 0.2 0.2 0.2 0.6
ƽ���� 0.8 0.8 0.2 0.6
��������ʽ���з�����ɡ�
�ۼ���������Ӧ�ų����������ṩ����������������Ӧ�����������������ﵽ������á�
��3����.����ͼʾ��������һ����Ӧ�ǻ�ԭ����������������ԭΪ�����ڶ�����Ӧ������̼�������Ϊ��������������������ԭΪһ����̼��
��.��Ӧ�����̣���CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)����4H2(g)+ Fe3O4(s)
2CO(g)+2H2(g)����4H2(g)+ Fe3O4(s) ![]() 3Fe(s)+4 H2O(g)����Fe3O4(s)+4CO(g)
3Fe(s)+4 H2O(g)����Fe3O4(s)+4CO(g) ![]() 3Fe(s)+ 4CO2(g)��������Ӧ��ȥFe3O4��Fe�����յõ�CH4(g)+3CO2(g)
3Fe(s)+ 4CO2(g)��������Ӧ��ȥFe3O4��Fe�����յõ�CH4(g)+3CO2(g) ![]() 2H2O(g)+ 4CO(g)��ֻ�й���IͶ�ϱ�
2H2O(g)+ 4CO(g)��ֻ�й���IͶ�ϱ�![]() ��������ɲŻᱣ�ֲ��䡣
��������ɲŻᱣ�ֲ��䡣
��1������ȼ������һ�ְ�ɫ���壬�м�ǿ��ȼ�������ŵ��ǣ������ܶȸߡ���ࡢ��ȾС�������ʴ�Ϊ�������ܶȸߡ���ࡢ��ȾС��������
��2���ٴӱ��л�����ݿ����ڳ�ʼ�Σ���������������Ӧ��ܽϴ����������ķ�Ӧ��ܾ���С�����Լ��������ķ�Ӧ���ʿ죬�ʴ�Ϊ��С�ڡ�
�ڼ��������1mol��ˮ������1mol��
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼ�� 1 1 0 0
�仯�� 0.2 0.2 0.2 0.6
ƽ���� 0.8 0.8 0.2 0.6
ƽ����������������0.8 + 0.8 + 0.2 + 0.6=2.4mol��p(CH4)= p(H2O)=4/3��p(CO)=1/3��p(H2)=1��A���ƽ�ⳣ��Kp=13��1/3��(4/3)2=3/16(Mpa)2,����ͼ��������¶Ȳ���ʱ��ѹǿ��С��ƽ�����ƣ������ת��������ѹǿ(p1��p2��p3��p4)�ɴ�С��˳��Ϊ��p1>p2>p3>p4���ʴ�Ϊ��3/16(Mpa)2��0.1875( Mpa)2 ��p1>p2>p3>p4 ��
�ۼ���������Ӧ�ų����������ṩ����������������Ӧ�����������������ﵽ������ã��ʴ�Ϊ������������Ӧ�ų�����������������������Ӧ���������������ﵽ����ƽ�⡣
��3����.����ͼʾ��������һ����Ӧ�ǻ�ԭ����������������ԭΪ�����ڶ�����Ӧ������̼�������Ϊ��������������������ԭΪһ����̼���ʴ�Ϊ��3Fe+4CaCO3![]() Fe3O4+4CaO+4CO����
Fe3O4+4CaO+4CO����
��.����II�Ĵ����ǣ�Fe3O4��CaO����Ӧ�����̣���CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)����4H2(g)+ Fe3O4(s)
2CO(g)+2H2(g)����4H2(g)+ Fe3O4(s) ![]() 3Fe(s)+4 H2O(g)����Fe3O4(s)+4CO(g)
3Fe(s)+4 H2O(g)����Fe3O4(s)+4CO(g) ![]() 3Fe(s)+ 4CO2(g)��������Ӧ��ȥFe3O4��Fe�����յõ�CH4(g)+3CO2(g)
3Fe(s)+ 4CO2(g)��������Ӧ��ȥFe3O4��Fe�����յõ�CH4(g)+3CO2(g) ![]() 2H2O(g)+ 4CO(g)��ֻ�й���IͶ�ϱ�
2H2O(g)+ 4CO(g)��ֻ�й���IͶ�ϱ�![]() ��������ɲŻᱣ�ֲ��䡣�ʴ�Ϊ��Fe3O4��CaO ��1/3��
��������ɲŻᱣ�ֲ��䡣�ʴ�Ϊ��Fe3O4��CaO ��1/3��


 ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д� Ӣ�ŵ��ϵ�д�
Ӣ�ŵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ�������²��ö���Ե缫�Ĵ����س��װ�ã����������л������֪����װ�õĵ���Ч��![]() ��100%������˵������ȷ����
��100%������˵������ȷ����
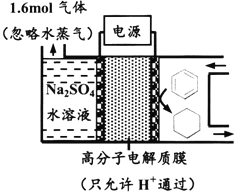
A. ���ö�缫�����˽Ӵ�������ɽ��͵��������ʧ
B. ������ͨ��C-H���Ķ���ʵ����Ĵ���
C. ����Ŀ�����ĵ缫��ӦʽΪC6H6+6e-+6H+===C6H12
D. ��![]() =75%����μӷ�Ӧ�ı�Ϊ0.8mol
=75%����μӷ�Ӧ�ı�Ϊ0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ͨ���Ȼ�ѧѭ���ڽϵ��¶�����ˮ������ֽ��Ʊ������ķ�Ӧϵͳԭ��������˵������ȷ����

A. ��Ӧ��Ϊ��Ӧ���ṩ��ԭ��
B. ��Ӧ��Ҳ��SO2��Դ���õķ���֮һ
C. �Ƶõ���H2�����������ٵ���ϵͳ(I)
D. ϵͳ(I)������Ȼ�ѧ����ʽΪH2O(l) ![]() H2(g) + 1/2O2(g) ��H = +286 kJ/mol
H2(g) + 1/2O2(g) ��H = +286 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��X(g)+2Y(g)![]() 2Z(g) ��2M(g)
2Z(g) ��2M(g)![]() N(g)+P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܷ���塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ��
N(g)+P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܷ���塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ��

��Ӧ��ʼ ƽ�⣨I�� ƽ�⣨II��
�����ж���ȷ����
A. ��ƽ��(I)ʱ��ϵ��ѹǿ�뷴Ӧ��ʼʱ��ϵ��ѹǿ֮��Ϊ10��11
B. ��Ӧ��������Ӧ�����ȷ�Ӧ
C. ��ƽ��(I)��ƽ��(II)�У�M������������
D. ��ƽ��(I)ʱ��X��ת����Ϊ50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
Prolitane��һ�ֿ�����ҩ��Է�����AΪԭ�ϵĺϳ�·�����£�

��ش��������⣺
(1)D�Ļ�ѧ����Ϊ___________��D��E�ķ�Ӧ����Ϊ___________��
(2)G�Ĺ���������Ϊ___________��
(3)B�Ľṹ��ʽΪ______________________��
(4)F��G�Ļ�ѧ����ʽΪ______________________��
(5)X��D��ͬϵ������ӱ�D������һ��̼ԭ�ӣ����ܷ���������Ӧ���������������X����___________��(���������칹)�������˴Ź���������ʾΪ5��壬��������Ϊ3�U2�U2�U2�U1��д�����ϸ�Ҫ�������һ��ͬ���칹��Ľṹ��ʽ��______________________��
(6)���� Prolitane�ĺϳ�·�ߣ����һ���ɱ����Ҵ�Ϊԭ���Ʊ������������ĺϳ�·��(�������Լ����ܼ���ѡ)��____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա����̫���ܣ������ˮ��H2�����������������ܴ������߹��ˮ��H2��Ч�ʣ������ѳ�SO2������ԭ����ͼ��ʾ������˵������ȷ����
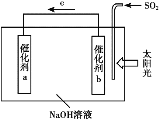
A. ��װ�ÿɽ�̫����ת��Ϊ��ѧ��
B. ����a���淢����ԭ��Ӧ������H2
C. ����b��������ҺpH����
D. ����1 mol SO2���������ܲ���1 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1.000 mol/L�������20.00 mL 1.000 mo1/L��ˮ�У���ҺpH���¶��������������仯��������ͼ��ʾ�������й�˵����ȷ����( )
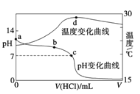
A. a����ˮ�������c(H+) = 1.0 �� 10-14 mo1/L
B. b�㣺c(NH4��) > c(Cl��) > c(OH��) > c(H��)
C. c�㣺�����백ˮǡ����ȫ��Ӧ
D. d�����Һ�¶����½�����Ҫԭ����NH3��H2O��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol H2��1mol I2���ں��º����ܱ������з�����Ӧ��H2(g)+I2(g)![]() 2HI(g)+9.4kJ����t1ʱ�̵���ƽ��״̬�������������뷴Ӧʱ��Ĺ�ϵ��������ʵ���ǣ� ��
2HI(g)+9.4kJ����t1ʱ�̵���ƽ��״̬�������������뷴Ӧʱ��Ĺ�ϵ��������ʵ���ǣ� ��
|
|
|
|
A | B | C | D |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���ǻ��Ϸ�Ӧ������������ԭ��Ӧ���ǣ�������
A.2CO+O2![]() 2CO2B.CaO+H2O=Ca(OH)2
2CO2B.CaO+H2O=Ca(OH)2
C.C+H2O![]() CO+H2D.CO2+Ca(OH)2=CaCO3��+H2O
CO+H2D.CO2+Ca(OH)2=CaCO3��+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com