
����Ŀ����1����������Ҫ�Ļ���ԭ�ϣ���Ҫ�������ʡ��䶳���ȡ�����һ�̶��ݻ��ķ�Ӧ����ͨ��2molN2��6molH2�ڴ��������¼�����ƽ��״̬����ô�ʱ������ѹǿ�ȷ�Ӧǰ��С��![]() ����ʽ����H2��ƽ��ת����___��
����ʽ����H2��ƽ��ת����___��
��2��ȼ�ϵ�ȼ�ս���ѧ��ת�������ܣ��ṩ����������ͷ�չ����Ҫ�������Ͷ������ֽ������8.96L�������ϩ�Ļ�����������������ֻ�ϲ���ȼ��ȼ�ղ��ᆳ��Ũ���������պ�����16.2g�������������������ϩ�����ʵ���֮��Ϊ����___��
���𰸡�40% 1:3
��������
��1���跴Ӧ�ﵽƽ��ʱ��������Ӧ��xmol��
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
��ʼ(mol) 2 6 0
�仯(mol) x 3x 2x
ƽ��(mol) (2-x) (6-3x) 2x
�������⣬��![]() �����x=0.8��
�����x=0.8��
������ƽ��ת����![]() ��
��
��2��������������������ʵ���Ϊxmol����ϩ�����ʵ���Ϊymol
![]() ��
��
![]() ��
��
��������x+y=0.4��3x+2y=0.9��
���y=0.3��x=0.1���ʻ���������������ϩ�����ʵ���֮��Ϊ1:3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̫���ܵ�����Ա���Ϳ����(Rii)��������TiO2����Ⱦ�ϵ������粣���Ͷ�Pt���粣��Ϊ���塣�乤��ԭ������ͼ��ʾ��

���й��ڸõ��������ȷ����
A. ��ع���ʱ�����ɹ���ֱ��ת�����������漰��ѧ��ת��
B. ��ع������ܷ�ӦΪ��RuII+I3-=RuIII+3I-
C. ��̫�����������Ⱦ��ʱ������Ⱦ�����ڵ缫�ĵ��Ƶ��ڶ�Pt���粣���缫
D. ��ع���ʱ��Ϊ�������磬��Ҫ���ڲ����йص����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��X(g)+2Y(g)![]() 2Z(g) ��2M(g)
2Z(g) ��2M(g)![]() N(g)+P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܷ���塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ��
N(g)+P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܷ���塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ��

��Ӧ��ʼ ƽ�⣨I�� ƽ�⣨II��
�����ж���ȷ����
A. ��ƽ��(I)ʱ��ϵ��ѹǿ�뷴Ӧ��ʼʱ��ϵ��ѹǿ֮��Ϊ10��11
B. ��Ӧ��������Ӧ�����ȷ�Ӧ
C. ��ƽ��(I)��ƽ��(II)�У�M������������
D. ��ƽ��(I)ʱ��X��ת����Ϊ50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա����̫���ܣ������ˮ��H2�����������������ܴ������߹��ˮ��H2��Ч�ʣ������ѳ�SO2������ԭ����ͼ��ʾ������˵������ȷ����
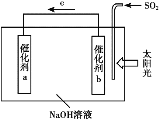
A. ��װ�ÿɽ�̫����ת��Ϊ��ѧ��
B. ����a���淢����ԭ��Ӧ������H2
C. ����b��������ҺpH����
D. ����1 mol SO2���������ܲ���1 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1.000 mol/L�������20.00 mL 1.000 mo1/L��ˮ�У���ҺpH���¶��������������仯��������ͼ��ʾ�������й�˵����ȷ����( )
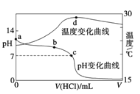
A. a����ˮ�������c(H+) = 1.0 �� 10-14 mo1/L
B. b�㣺c(NH4��) > c(Cl��) > c(OH��) > c(H��)
C. c�㣺�����백ˮǡ����ȫ��Ӧ
D. d�����Һ�¶����½�����Ҫԭ����NH3��H2O��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����Ԫ�صķǽ����Ա���Ԫ��ǿ���ǣ� ��
A. �ܽ��ԣ�HCl > H2SB. Cl2+H2S��2HCl+S
C. �ȶ��ԣ� HCl > H2SD. 3Cl2+2Fe![]() 2FeCl3��S+Fe
2FeCl3��S+Fe![]() FeS
FeS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol H2��1mol I2���ں��º����ܱ������з�����Ӧ��H2(g)+I2(g)![]() 2HI(g)+9.4kJ����t1ʱ�̵���ƽ��״̬�������������뷴Ӧʱ��Ĺ�ϵ��������ʵ���ǣ� ��
2HI(g)+9.4kJ����t1ʱ�̵���ƽ��״̬�������������뷴Ӧʱ��Ĺ�ϵ��������ʵ���ǣ� ��
|
|
|
|
A | B | C | D |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��¿��淴Ӧ��A(s)��2B(g)![]() 2C(g)��D(g) ��H��0���ֽ�1 mol A��2 mol B����������У���4 mol C��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬����ͼ1��ʾ������K�����ƶ���������˵����ȷ���ǣ� ��
2C(g)��D(g) ��H��0���ֽ�1 mol A��2 mol B����������У���4 mol C��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬����ͼ1��ʾ������K�����ƶ���������˵����ȷ���ǣ� ��

A. ���ֻ���λ�ò��䣬�����¶ȣ��ﵽ�µ�ƽ��ס�����B�������������С
B. �����¶Ⱥͻ���λ�ò��䣬�ڼ����ټ���1 mol A��2 mol B���ﵽ�µ�ƽ�����C��Ũ��������C��Ũ�ȵ�2��
C. �����¶Ⱥ����е�ѹǿ���䣬t2ʱ�ֱ���ס����м���������ĺ����ס����з�Ӧ���ʱ仯����ֱ���ͼ2��ͼ3��ʾ��t1ǰ�ķ�Ӧ���ʱ仯��ʡ�ԣ�
D. �����¶Ȳ��䣬�ƶ�����P��ʹ�ҵ��ݻ��ͼ���ȣ��ﵽ�µ�ƽ�������C����������Ǽ���C�����������2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��Ϊ̽��Na2CO3��Һ������,��Ҫ480mL 0.2molL-1��Na2CO3��Һ����Һ�����ƹ�����ͼ��ʾ��

(1)ָ�����ƹ������������Դ���_______________.
(2)��������������������ҺŨ�Ȳ�����Ӱ�죺��������������ҺŨ��ƫ�ߵ���__________(�����,��ͬ)��ƫ�͵���________����Ӱ�����________��
�����������������ķ�������(ʹ������)����̼���Ʋ��������л����Ȼ��ƣ�������ƿδ������ʹ�ã��ܳ���̼����ʱ�����������⣻����Һ��������������Һ������
(3)������Ƶ�0.2molL-1��Na2CO3��Һ50mL������μ���0.2molL-1��Ba(OH)2��Һ50mL���ù����з�����Ӧ�����ӷ���ʽΪ_____����Ӧ��������Һ�����ʵ����ʵ���Ũ��Ϊ_____molL-1(������Һ����仯)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com