
【题目】VmLFe2(SO4)3溶液中含有agFe3+,取出溶液中的四分之一,将其稀释到3VmL,则稀释后溶液中SO42-的物质的量浓度是
A.![]() molL-1B.
molL-1B.![]() molL-1C.
molL-1C.![]() molL-1D.
molL-1D.![]() molL-1
molL-1
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A. 容器内压强不随时间变化
B. 容器内气体密度不随时间变化
C. 容器内X、Y、Z的浓度之比为1:2:2
D. 单位时间消耗0.1molX同时生成0.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述正确的是( )
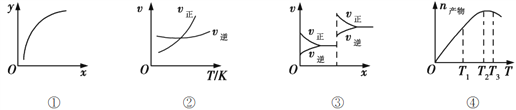
A. 图①表示在恒容容器中MgSO4(s) + CO(g)![]() MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
B. 图②表示其他条件一定时,反应A(g)+3B(g)![]() 2C(g)的反应速率随温度变化的图像,正反应ΔH>0
2C(g)的反应速率随温度变化的图像,正反应ΔH>0
C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况
D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g)![]() 2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都是前20号元素中的常见元素,且核电荷数递增。A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6gD单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同。请回答下列问题:
(1)写出A、B、D的元素符号:A______;B_____;D______。
(2)C离子的电子式_______;E的离子结构示意图_______。
(3)写出电解D、E形成化合物的水溶液的化学反应方程式______。
(4)工业上将E的单质通入石灰乳[Ca(OH)2]制取漂粉精,化学反应方程式为______。漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的某种物质,该化学反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。C是海水中最多的盐,D是常见的无色液体。E和G为无色气体,其中E能使湿润的红色石蕊试纸变蓝。B、C、I、J的焰色反应为黄色,其中I可用于制发酵粉或治疗胃酸过多。

⑴F的化学式为______。E的电子式为______。
⑵写出反应①的离子方程式:______。
⑶写出反应②的化学方程式:______。
⑷写出反应③的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.葡萄糖在人体内的氧化反应是放热反应
B.某些物质在空气中燃烧是吸热反应
C.强酸、强碱的中和反应是放热反应,弱酸、弱碱的中和反应是吸热反应
D.铝分别与盐酸和稀硫酸反应,前者是放热反应,后者是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(1)ΔH=-57.3kJ·mol-1、计算下列中和反应放出的热量
(1)用20g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出___________kJ的热量
(2)用1mol醋酸稀溶液和足量的NaOH稀溶液反应,放出的热量 __________57.3kJ(填 “>”、“<”、或“=”)理由是______________________________________ 。
(3)1L0.1mol/L NaOH溶液分别与①醋酸溶液;②浓硫酸;③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位kJ)。则它们由大到小的顺序为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出基态Fe2+的核外电子排布式______________________;基态C1原子电子占据最高能级的电子云轮廓图为___________形。
(2)SO42-中心原子的轨道杂化类型为___________;NO3-的空间构型为___________。
(3)萤石晶胞结构如图I所示,则Ca2+的配位数是___________,萤石的化学式为 ___________。

(4)NiO氧化镍)晶胞结构如图Ⅱ所示,则每个Ni2+周围与其等距离的Ni2+有___________个;若Ni2+与最邻近O2-的核间距为a×10-8cm,则NiO晶体的密度为___________g·cm-3(列出计算式)(已知NiO的摩尔质量为74.7g·mol-1,阿伏加德罗常数的值为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com