
【题目】根据已学物质结构与性质的有关知识,回答下列问题:
(1)某元素被科学家称之为人体微量元素中的“防癌之王”,其基态原子的外围电子排布是4s24p4,该元素的名称是____________。
(2)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种,该周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但是30Zn与31Ga的第一电离能不符合这一规律,原因是________________________________________。
(3)AsH3中心原子的杂化类型为________;一定压强下将AsH3、NH3、PH3的混合气体降温时首先液化的是________,理由是______________________________________。
(4)配合物Fe(CO)5的配位体是________;常温下,Fe(CO)5为黄色液体,熔点为251 K,沸点为376 K,据此,可判断Fe(CO)5晶体属于________晶体。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________;已知两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______。

【答案】 硒 3 30Zn的4s能级有2个电子,处于全满状态,较稳定 sp3杂化 NH3 NH3分子之间有氢键,沸点较高 CO 分子 1∶2 3![]() :8
:8
【解析】(1)某基态原子的外围电子排布是4s24p4,原子序数等于34,因此该元素的名称是硒;(2)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有K、Cr、Cu,共计是3种。由于30Zn的4s能级有2个电子,处于全满状态,较稳定,因此第一电离能大于31Ga的。(3)AsH3中心原子As的价层电子对数=3+(5-3×1)/2=4,所以杂化类型为sp3杂化;由于NH3分子之间有氢键,沸点较高,因此一定压强下将AsH3、NH3、PH3的混合气体降温时首先液化的是NH3。(4)配合物Fe(CO)5中铁含有空轨道,配位体是CO;常温下,Fe(CO)5为黄色液体,熔点为251 K,沸点为376 K,熔沸点较低,这说明Fe(CO)5晶体属于分子晶体。(5)体心立方晶胞中铁原子个数=1+8×1/8=2;面心立方晶胞中实际含有的Fe原子个数=6×1/2+8×1/8=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;
设体心立方中晶胞的棱长为x,铁原子的直径为A,则3x2=(2A)2,解得x= ![]() ;铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长=
;铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长= ![]() ,其晶胞体积=
,其晶胞体积=![]() 。体心立方的密度与面心立方的密度之比=
。体心立方的密度与面心立方的密度之比=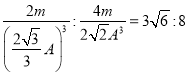 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列粒子半径比较中,正确的是( )
A. Na+<Mg2+<Al3+<K+B. S2->Cl->K+>Ca2+
C. O2->S2->Cl->Br-D. F->Li+>Na+>S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 molL-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=l00mL,Va、Vb与混合液的pH的关系如图所示。 下列说法正确的是

A. Ka(HA)=10-6mol·L-1
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. c点时,  随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年,科学家首先从人尿中分离出具有生长素效应的化学物质一吲哚乙酸,吲哚乙酸的结构如图所示。下列有关吲哚乙酸的说法正确的是

A. 吲哚乙酸的分子式是C10H10NO2
B. 吲哚乙酸苯环上的二氯代物共有四种(不考虑立体异构)
C. 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应
D. 1 mol吲哚乙酸与足量氢气发生加成反应时,最多可以消耗5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯和甲苯的说法正确的是
A. 甲苯苯环上的一个氢原子被-C3H7取代得到的有机物结构共有3种
B. 等质量的苯和甲苯分别完全燃烧后,生成的CO2与消耗的O2的物质的量均相同
C. 苯的二溴代物有三种,则四溴代物有三种
D. 间二甲苯只有一种结构可说明苯分子中不存在碳碳单键与碳碳双键交替的结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:SO32->I-。某溶液X可能含有NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,为确定其组成,某同学进行如下实验:

下列说法正确的是
A. 溶液X肯定只存在NH4+、SO42-
B. 溶液X一定不含有Ba2+、Fe3+,可能含有I-
C. 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液
D. 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在酸性溶液中能大量共存,且溶液为无色透明的是
A. K+、MnO4-、Cl-、SO42- B. Na+、CO32-、 Cl-、SO42-
C. NO3-、Na+、HCO3-、Ba2+ D. Na+、NO3-、NH4+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是
A. 烧菜用过的铁锅,经放置常出现红棕色斑迹
B. 用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量
C. 牛奶久置变质腐败
D. 氧化铜固体加入稀盐酸中,完全溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com