
°æƒø°øª™∑®¡÷(Warfarin )”÷√˚…± Û¡È£¨Œ™–ƒ—™πк≤≤°µƒ¡Ÿ¥≤“©ŒÔ°£∆‰∫œ≥…¬∑œþ(≤ø∑÷∑¥”¶Ãıº˛¬‘»•)»ÁÕºÀ˘ æ
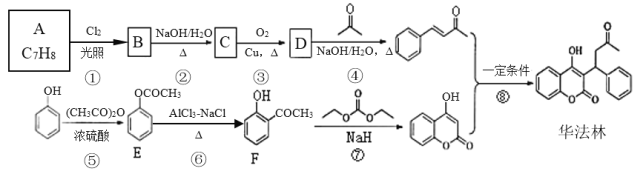
ªÿ¥œ¬¡–Œ Â
¢≈Aµƒ√˚≥∆Œ™______£¨F÷–πŸƒÐÕ≈√˚≥∆Œ™________°¢________°£
¢∆BµƒΩ·ππºÚ ΩŒ™_____°£¢€µƒ∑¥”¶¿ý–ÕŒ™_____£¨¢ýµƒ∑¥”¶¿ý–ÕŒ™_____°£
¢«‘⁄“ª∂®Ãıº˛œ¬l mol µƒª™∑®¡÷◊Ó∂ý∑¥”¶_______molH2
¢»–¥≥ˆ”…C …˙≥… D µƒªØ—ß∑Ω≥Ã ΩŒ™ ___________£ª
¢…FµƒÕ¨∑÷“ÏππÃÂ…ı∂ý£¨¬˙◊„œ¬¡–Ãıº˛£∫¢Ÿ Ù∑ºœ„◊ªØ∫œŒÔ¢⁄∑¢…˙“¯æµ∑¥”¶¢€∫ÕNaOH»Ð“∫∑¥”¶£¨π≤___÷÷£¨∆‰÷–”ˆ¬»ªØÃ˙œ‘◊œ…´«“±Ωª∑…œµƒ“ª¬»¥˙ŒÔ÷ª”–¡Ω÷÷Ω·ππµƒΩ·ππºÚ Ω_________°£
¢ »ÙDŒ™““»©£¨∞¥øÚÕº÷–¢ÐÕ¨—˘µƒ∑¥”¶ŒÔ∫ÕÃıº˛£¨–¥≥ˆ…˙≥…ŒÔµƒΩ·ππºÚ Ω_____°£
°æ¥∞∏°øº◊±Ω ∑”Ù«ª˘ªÚÙ«ª˘ Ù ª˘ ![]() —ıªØ∑¥”¶ º”≥…∑¥”¶ 8 2
—ıªØ∑¥”¶ º”≥…∑¥”¶ 8 2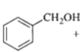 +O2
+O2![]() 2
2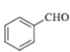 +2H2O 17
+2H2O 17 ![]() CH3CH=CHCOCH3
CH3CH=CHCOCH3
°æΩ‚Œˆ°ø
º◊±Ω∫Õ¬»∆¯π‚’’œ¬»°¥˙∑¥”¶…˙≥…B(![]() )£¨B(
)£¨B(![]() )‘⁄«‚—ıªØƒ∆°¢º”»»Ãıº˛œ¬∑¢…˙»°¥˙∑¥”¶…˙≥…C(
)‘⁄«‚—ıªØƒ∆°¢º”»»Ãıº˛œ¬∑¢…˙»°¥˙∑¥”¶…˙≥…C(![]() )£¨C(
)£¨C(![]() )¥þªØº¡◊˜”√œ¬”Ηı∆¯∑¥”¶…˙≥…D(
)¥þªØº¡◊˜”√œ¬”Ηı∆¯∑¥”¶…˙≥…D( )£¨D(
)£¨D( )∫Õ
)∫Õ![]() ‘⁄«‚—ıªØƒ∆°¢º”»»Ãıº˛œ¬∑¥”¶…˙≥…
‘⁄«‚—ıªØƒ∆°¢º”»»Ãıº˛œ¬∑¥”¶…˙≥…![]() £¨±Ω∑”∫Õ(CH3CH2)O‘⁄≈®¡ÚÀ·◊˜”√œ¬∑¥”¶…˙≥…E(
£¨±Ω∑”∫Õ(CH3CH2)O‘⁄≈®¡ÚÀ·◊˜”√œ¬∑¥”¶…˙≥…E(![]() )£¨E‘⁄¬»ªØƒ∆°¢¬»ªØ¬¡º”»»Ãıº˛œ¬∑¥”¶…˙≥…F(
)£¨E‘⁄¬»ªØƒ∆°¢¬»ªØ¬¡º”»»Ãıº˛œ¬∑¥”¶…˙≥…F(![]() )£¨
)£¨![]() ”Î
”Î![]() ‘⁄NaH◊˜”√œ¬∑¥”¶…˙≥…
‘⁄NaH◊˜”√œ¬∑¥”¶…˙≥…![]() £¨
£¨![]() ”Î
”Î![]() “ª∂®Ãıº˛œ¬∑¥”¶…˙≥…ª™∑®¡÷°£
“ª∂®Ãıº˛œ¬∑¥”¶…˙≥…ª™∑®¡÷°£
¢≈∏˘æð∑÷ŒˆAµƒ√˚≥∆Œ™º◊±Ω£¨F÷–πŸƒÐÕ≈√˚≥∆Œ™Ù«ª˘°¢Ù ª˘£ªπ ¥∞∏Œ™£∫º◊ª˘£ª∑”Ù«ª˘ªÚÙ«ª˘£ªÙ ª˘°£
¢∆º◊±Ω”ά»∆¯‘⁄π‚’’Ãıº˛œ¬∑¢…˙»°¥˙∑¥”¶…˙≥…B£¨BµƒΩ·ππºÚ ΩŒ™![]() °£¢€ «¥º±‰»©µƒ∑¥”¶£¨“Ú¥À∆‰∑¥”¶¿ý–ÕŒ™—ıªØ∑¥”¶£¨¢ý «¡Ω÷÷ŒÔ÷ ∑¥”¶…˙≥…“ª÷÷ŒÔ÷ £¨√ª”–∆‰À˚ŒÔ÷ …˙≥…£¨“Ú¥À∑¥”¶¿ý–ÕŒ™º”≥…∑¥”¶£ªπ ¥∞∏Œ™£∫
°£¢€ «¥º±‰»©µƒ∑¥”¶£¨“Ú¥À∆‰∑¥”¶¿ý–ÕŒ™—ıªØ∑¥”¶£¨¢ý «¡Ω÷÷ŒÔ÷ ∑¥”¶…˙≥…“ª÷÷ŒÔ÷ £¨√ª”–∆‰À˚ŒÔ÷ …˙≥…£¨“Ú¥À∑¥”¶¿ý–ÕŒ™º”≥…∑¥”¶£ªπ ¥∞∏Œ™£∫![]() £ª—ıªØ∑¥”¶£ªº”≥…∑¥”¶°£
£ª—ıªØ∑¥”¶£ªº”≥…∑¥”¶°£
¢«‘⁄“ª∂®Ãıº˛œ¬l mol µƒª™∑®¡÷∫¨”–2mol±Ωª∑£¨1molúúÀ´º¸£¨1molÙ ª˘£¨“Ú¥À◊Ó∂ý∑¥”¶8 molH2£ªπ ¥∞∏Œ™£∫8°£
¢»”…C …˙≥… D «¥º¥þªØ—ıªØ≥…»©µƒ∑¥”¶£¨∆‰ªØ—ß∑Ω≥Ã ΩŒ™2 +O2
+O2![]() 2
2 +2H2O£ªπ ¥∞∏Œ™£∫2
+2H2O£ªπ ¥∞∏Œ™£∫2 +O2
+O2![]() 2
2 +2H2O°£
+2H2O°£
¢…FµƒÕ¨∑÷“ÏππÃÂ…ı∂ý£¨¬˙◊„œ¬¡–Ãıº˛£∫¢Ÿ Ù∑ºœ„◊ªØ∫œŒÔ£¨∫¨”–±Ωª∑£ª¢⁄∑¢…˙“¯æµ∑¥”¶£¨Àµ√˜∫¨”–»©ª˘£¨ªÚº◊À·ı•£¨¢€∫ÕNaOH»Ð“∫∑¥”¶£¨∫¨”–∑”Ù«ª˘ªÚı•£ªµ±∫¨”–°™CH2CHO∫Õ°™OH£¨¡⁄°¢º‰°¢∂‘»˝÷÷£ª∫¨”–°™CHO°¢°™OH°¢°™CH3£¨µ±°™CHO°¢°™OH‘⁄¡⁄Œª ±£¨”–Àƒ÷÷£ªµ±°™CHO°¢°™OH‘⁄º‰Œª ±£¨”–Àƒ÷÷£ªµ±°™CHO°¢°™OH‘⁄∂‘Œª ±£¨”–¡Ω÷÷£ª∫¨”–º◊ª˘∫Õ°™OOCH ±£¨¡⁄°¢º‰°¢∂‘»˝÷÷£¨∫¨”–°™CH2OOCH“ª÷÷£¨“Ú¥Àπ≤17÷÷£¨∆‰÷–”ˆ¬»ªØÃ˙œ‘◊œ…´«“±Ωª∑…œµƒ“ª¬»¥˙ŒÔ÷ª”–¡Ω÷÷Ω·ππµƒΩ·ππºÚ Ω![]() £ªπ ¥∞∏Œ™£∫17£ª
£ªπ ¥∞∏Œ™£∫17£ª![]() °£
°£
¢ ∑¥”¶¢Ð «»©ª˘∫Õ![]() –Œ≥…úúÀ´º¸£¨»ÙD «““»©£¨∞¥øÚÕº÷–¢ÐÕ¨—˘µƒ∑¥”¶ŒÔ∫ÕÃıº˛£¨…˙≥…ŒÔµƒΩ·ππºÚ ΩŒ™CH3CH=CHCOCH3£ªπ ¥∞∏Œ™£∫CH3CH=CHCOCH3°£
–Œ≥…úúÀ´º¸£¨»ÙD «““»©£¨∞¥øÚÕº÷–¢ÐÕ¨—˘µƒ∑¥”¶ŒÔ∫ÕÃıº˛£¨…˙≥…ŒÔµƒΩ·ππºÚ ΩŒ™CH3CH=CHCOCH3£ªπ ¥∞∏Œ™£∫CH3CH=CHCOCH3°£



| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»À¿ýµƒ≈©“µ…˙≤˙¿Î≤ªø™µ™∑ £¨º∏∫ıÀ˘”–µƒµ™∑ ∂º“‘∞±Œ™‘≠¡œ£¨ƒ≥ªØ—ß–À»§–°◊È¿˚”√Õº“ª◊∞÷√÷∆±∏∞±∆¯≤¢ÃΩæøœýπÿ–‘÷ °£
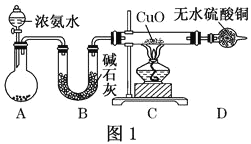
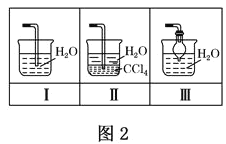
£®1£©◊∞÷√A÷–£¨ ¢”–≈®∞±ÀƵƒ“«∆˜√˚≥∆Œ™_____°£◊∞÷√Bµƒ◊˜”√ «______°£
£®2£©¡¨Ω”∫√◊∞÷√≤¢ºÏ—È◊∞÷√µƒ∆¯√Ж‘∫Û£¨◊∞»Î“©∆∑£¨»ª∫Û”¶œ»_____£®ÃÓIªÚ¢Ú£©°£
¢Ò£Æ¥Úø™–˝»˚÷µŒœÚ‘≤µ◊…’∆ø÷–º”»Î∞±ÀÆ
¢Ú£Æº”»»◊∞÷√C
£®3£© µ—È÷–π€≤ϵΩC÷–CuO∑€ƒ©±‰∫Ï£¨D÷–ŒÞÀÆ¡ÚÀ·Õ≠±‰¿∂£¨≤¢ ’ºØµΩ“ª÷÷µ•÷ ∆¯Ã£¨‘Ú∏√∑¥”¶œýπÿªØ—ß∑Ω≥Ã ΩŒ™______£¨∏√∑¥”¶÷§√˜∞±∆¯æþ”–ªπ‘≠–‘£ª∞±”Ηı∆¯‘⁄¥þªØº¡◊˜”√œ¬µƒ∑¥”¶“≤ÃÂœ÷¡À’‚“ª–‘÷ £¨∏√∑¥”¶ªØ—ß∑Ω≥Ã ΩŒ™______°£
£®4£©∏√ µ—È»±…ŸŒ≤∆¯Œ¸ ’◊∞÷√£¨Õº∂˛÷–ƒÐ”√¿¥Œ¸ ’Œ≤∆¯µƒ◊∞÷√ «_____£®ÃÓ◊∞÷√–Ú∫≈£©°£
£®5£© µ—È “ªπø…”√Õº»˝À˘ æ◊∞÷√÷∆±∏∞±∆¯£¨ªØ—ß∑¥”¶∑Ω≥Ã ΩŒ™_____°£
£®6£©Ω´3.2gÕ≠”Î60.0mL“ª∂®≈®∂»µƒœıÀ·∑¢…˙∑¥”¶£¨Õ≠ÕÍ»´»ÐΩ‚£¨≤˙…˙NO2∫ÕNOªÏ∫œ∆¯ÃµƒÃª˝Œ™ 8.96L(±Íøˆ)°£¥˝≤˙…˙µƒ∆¯Ã»´≤ø Õ∑≈∫Û£¨œÚ»Ð“∫º”»Î 100mL2.0mol/L µƒ NaOH»Ð“∫£¨«°∫√ π»Ð“∫÷–µƒCu2+»´≤ø◊™ªØ≥…≥¡µÌ£¨‘Ú‘≠œıÀ·»Ð“∫µƒ≈®∂»Œ™ _______________mol/L°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∑®π˙∏Ò¿’≈µ≤º∂˚(![]() )‘º…™∑Ú©q∏µ¡¢“∂¥Û—ßµƒ—–æø–°◊È∑¢√˜¡Àµ⁄“ªøÈø…÷≤»Î»ÀÃÂŒ™»À‘Ï∆˜πŸÃ·π©µÁƒÐµƒ∆œÃ—ë…˙ŒÔ»º¡œµÁ≥ÿ£¨∆‰ª˘±æ‘≠¿Ì «∆œÃ—ë∫Õ—ı∆¯‘⁄»ÀÃÂ÷–√∏(µ∞∞◊÷ )µƒ◊˜”√œ¬∑¢…˙∑¥”¶£∫
)‘º…™∑Ú©q∏µ¡¢“∂¥Û—ßµƒ—–æø–°◊È∑¢√˜¡Àµ⁄“ªøÈø…÷≤»Î»ÀÃÂŒ™»À‘Ï∆˜πŸÃ·π©µÁƒÐµƒ∆œÃ—ë…˙ŒÔ»º¡œµÁ≥ÿ£¨∆‰ª˘±æ‘≠¿Ì «∆œÃ—ë∫Õ—ı∆¯‘⁄»ÀÃÂ÷–√∏(µ∞∞◊÷ )µƒ◊˜”√œ¬∑¢…˙∑¥”¶£∫![]() (À·–‘ª∑æ≥)°£œ¬¡–”–πÿ∏√µÁ≥ÿµƒÀµ∑®≤ª’˝»∑µƒ «( )
(À·–‘ª∑æ≥)°£œ¬¡–”–πÿ∏√µÁ≥ÿµƒÀµ∑®≤ª’˝»∑µƒ «( )
A.∏√…˙ŒÔ»º¡œµÁ≥ÿ≤ªƒÐ‘⁄∏þŒ¬œ¬π§◊˜
B.∏√µÁ≥ÿ∏∫º´µƒµÁº´∑¥”¶ ΩŒ™![]()
C.œ˚∫ƒ1mol—ı∆¯ ±◊™“∆4molµÁ◊”£¨![]() œÚ∏∫º´“∆∂Ø
œÚ∏∫º´“∆∂Ø
D.÷∏þ∆œÃ—ë…˙ŒÔ»º¡œµÁ≥ÿµƒ–߬ £¨ø…ƒÐ π∆‰‘⁄Ω´¿¥ø…“‘Œ™»Œ∫Œø…÷≤»Î“Ω¡∆…˱∏÷π©µÁƒÐ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø2019ƒÍ «°∞π˙º ªØ—ß‘™Àÿ÷Ð∆⁄±ÌƒÍ°±°£1869ƒÍ√≈Ωð¡–∑Ú∞—µ± ±“—÷™µƒ‘™Àÿ∏˘æðŒÔ¿Ì°¢ªØ—ß–‘÷ Ω¯––≈≈¡–£¨◊º»∑‘§¡Ù¡Àº◊°¢““¡Ω÷÷Œ¥÷™‘™ÀÿµƒŒª÷√£¨≤¢‘§≤‚¡À∂˛’þµƒœý∂‘‘≠◊”÷ ¡ø£¨≤ø∑÷‘≠ ºº«¬º»Áœ¬À˘ æ°£œ¬¡–Àµ∑®¥ÌŒÛµƒ «

A.º◊Œª”⁄œ÷––‘™Àÿ÷Ð∆⁄±Ìµ⁄Àƒ÷Ð∆⁄µ⁄¢ÛA◊Â
B.‘≠◊”∞Îæ∂±»Ωœ£∫º◊>““>Si
C.‘≠◊”–Ú ˝£∫º◊£≠Ca£Ω1
D.Õ∆≤‚““µƒµ•÷ ø…“‘”√◊˜∞εºÃÂ≤ƒ¡œ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∂‘œ¬¡– µ—È ¬ µµƒΩ‚ Õ’˝»∑µƒ «£® £©
œ÷œÛ | Ω‚ ÕªÚΩ·¬€ | |
A | SO2 πÀ·–‘∏þ√ÃÀ·ºÿ»Ð“∫Õ …´ | SO2±Ìœ÷∆Ø∞◊–‘ |
B | œÚƒ≥»Ð“∫÷–º”»ÎBaCl2»Ð“∫∫Õœ°HNO3£¨»Ù”–∞◊…´≥¡µÌ…˙≥… | ‘≠»Ð“∫÷–∫¨SO42- |
C | ”√≤¨Àø’∫»°ƒ≥»Ð“∫‘⁄æ∆æ´µ∆ª—Ê…œ◊∆…’÷±Ω”π€≤Ϫ—Ê—’…´£¨Œ¥º˚◊œ…´ | ‘≠»Ð“∫÷–≤ª∫¨K+ |
D | “Œ¬œ¬£¨œÚFeCl3»Ð“∫÷–µŒº”…Ÿ¡øKI»Ð“∫£¨‘ŸµŒº”º∏µŒµÌ∑€»Ð“∫£¨»Ð“∫±‰¿∂…´ | Fe3+µƒ—ıªØ–‘±»I2µƒ«ø |
A.AB.BC.CD.D
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øClO2”ÎCl2µƒ—ıªØ–‘œýΩ¸.‘⁄◊‘¿¥ÀÆœ˚∂æ∫Õπ˚ þ±£œ µ»∑Ω√Ê”¶”√π„∑∫.ƒ≥–À»§–°◊ÈÕ®π˝Õº1◊∞÷√£®º–≥÷◊∞÷√¬‘£©∂‘∆‰÷∆±∏°¢Œ¸ ’°¢ Õ∑≈∫Õ”¶”√Ω¯––¡À—–æø°£
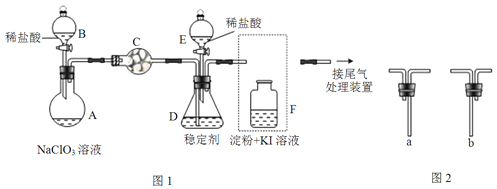
£®1£©“«∆˜Cµƒ√˚≥∆ «__°£∞≤◊∞F÷–µºπÐ ±£¨”¶—°”√Õº2÷–µƒ__°£
£®2£©¥Úø™BµƒªÓ»˚£¨A÷–∑¢…˙∑¥”¶£∫2NaClO3+4HCl=2ClO2°¸+Cl2°¸+2NaCl+2H2O.∏√∑¥”¶÷–—ıªØº¡”Ϊπ‘≠º¡ŒÔ÷ µƒ¡ø÷Ʊ»Œ™__£¨Œ™ πClO2‘⁄D÷–±ªŒ»∂®º¡≥‰∑÷Œ¸ ’£¨µŒº”œ°—ŒÀ·µƒÀŸ∂»“À___£®ÃÓ°∞øÏ°±ªÚ°∞¬˝°±£©°£
£®3£©πÿ±’BµƒªÓ»˚£¨ClO2‘⁄D÷–±ªŒ»∂®º¡ÕÍ»´Œ¸ ’…˙≥…NaClO2£¨¥À ±F÷–»Ð“∫µƒ—’…´≤ª±‰£¨‘Ú◊∞÷√Cµƒ◊˜”√ «___°£
£®4£©“—÷™‘⁄À·–‘Ãıº˛œ¬NaClO2ø…∑¢…˙∑¥”¶…˙≥…NaCl≤¢ Õ∑≈≥ˆClO2£¨∏√∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™___£¨‘⁄ClO2 Õ∑≈ µ—È÷–£¨¥Úø™EµƒªÓ»˚£¨D÷–∑¢…˙∑¥”¶£¨‘Ú◊∞÷√Fµƒ◊˜”√ «___°£
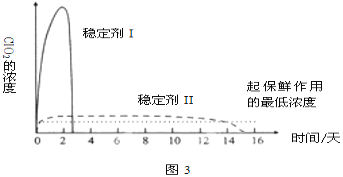
£®5£©“—Œ¸ ’ClO2∆¯ÃµƒŒ»∂®º¡¢Ò∫Õ¢Ú£¨º”À·∫Û Õ∑≈ClO2µƒ≈®∂»ÀÊ ±º‰µƒ±‰ªØ»ÁÕº3À˘ 棨»ÙΩ´∆‰”√”⁄ÀÆπ˚±£œ £¨ƒ„»œŒ™–ßπ˚Ωœ∫√µƒŒ»∂®º¡ «__£¨‘≠“Ú «__°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∫£ÀÆ÷–∫¨”–∑·∏ªµƒ√æ◊ ‘¥°£ƒ≥Õ¨—߅˺∆¡À¥”ƒ£ƒ‚∫£ÀÆ÷–÷∆±∏MgOµƒ µ—È∑Ω∞∏£∫
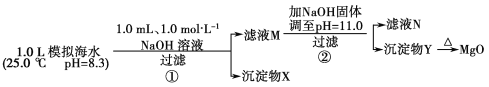
ƒ£ƒ‚∫£ÀÆ÷–µƒ¿Î◊”≈®∂»/mol°§L£≠1 | Na£´ | Mg2£´ | Ca2£´ | Cl£≠ | HCO3£≠ |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
◊¢£∫»Ð“∫÷–ƒ≥÷÷¿Î◊”µƒ≈®∂»–°”⁄1.0°¡10£≠5 mol°§L£≠1£¨ø…»œŒ™∏√¿Î◊”≤ª¥Ê‘⁄£ª µ—Èπ˝≥Ã÷–£¨ºŸ…˻Г∫ê˝≤ª±‰°£Ksp[CaCO3]£Ω4.96°¡10£≠9£¨Ksp[MgCO3]£Ω6.82°¡10£≠6£¨Ksp[Ca(OH)2]£Ω4.68°¡10£≠6£¨Ksp[Mg(OH)2]£Ω5.61°¡10£≠12°£œ¬¡–Àµ∑®’˝»∑µƒ «£® £©
A.≥¡µÌŒÔXŒ™CaCO3
B.¬À“∫M÷–¥Ê‘⁄Mg2£´£¨≤ª¥Ê‘⁄Ca2£´
C.¬À“∫N÷–¥Ê‘⁄Mg2£´°¢Ca2£´
D.≤Ω÷Ë¢⁄÷–»Ù∏ƒŒ™º”»Î4.2 g NaOHπÃã¨≥¡µÌŒÔYŒ™Ca(OH)2∫ÕMg(OH)2µƒªÏ∫œŒÔ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øA°¢B°¢C°¢D∂º «÷–—ߪؗß÷–≥£º˚ŒÔ÷ £¨∆‰÷–A°¢B°¢Cæ˘∫¨”–Õ¨“ª÷÷‘™Àÿ£¨‘⁄“ª∂®Ãıº˛œ¬œýª•◊™ªØπÿœµ![]() ≤ø∑÷∑¥”¶÷–µƒÀÆ“—¬‘»•
≤ø∑÷∑¥”¶÷–µƒÀÆ“—¬‘»•![]() £Æ
£Æ
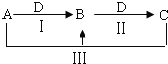
![]() »ÙAŒ™¬»ºÓ𧓵µƒ≤˙∆∑£¨CŒ™≥¯∑ø÷–µƒ”√∆∑£Æ
»ÙAŒ™¬»ºÓ𧓵µƒ≤˙∆∑£¨CŒ™≥¯∑ø÷–µƒ”√∆∑£Æ
![]() µƒµÁ◊” Ω «______£Æ
µƒµÁ◊” Ω «______£Æ
![]() ∑¥”¶¢Ûµƒ¿Î◊”∑Ω≥Ã Ω «______£Æ
∑¥”¶¢Ûµƒ¿Î◊”∑Ω≥Ã Ω «______£Æ
![]() ¬»ºÓ𧓵÷∆±∏AµƒªØ—ß∑Ω≥Ã Ω «______£¨∆‰÷–¡Ω÷÷≤˙ŒÔø…”ÎKI»Ð“∫∑¥”¶÷∆µ√“ª÷÷ªØπ§‘≠¡œ£¨»Ùœ˚∫ƒ
¬»ºÓ𧓵÷∆±∏AµƒªØ—ß∑Ω≥Ã Ω «______£¨∆‰÷–¡Ω÷÷≤˙ŒÔø…”ÎKI»Ð“∫∑¥”¶÷∆µ√“ª÷÷ªØπ§‘≠¡œ£¨»Ùœ˚∫ƒ![]() KI◊™“∆µÁ◊”
KI◊™“∆µÁ◊”![]() £¨‘Ú»˝÷÷ŒÔ÷ º‰∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ω «______£Æ
£¨‘Ú»˝÷÷ŒÔ÷ º‰∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ω «______£Æ
![]() »ÙA°¢Dæ˘Œ™µ•÷ £¨«“AŒ™∆¯Ã£¨D‘™Àÿµƒ“ª÷÷∫Ï◊ÿ…´—ıªØŒÔ≥£”√◊˜—’¡œ£Æ
»ÙA°¢Dæ˘Œ™µ•÷ £¨«“AŒ™∆¯Ã£¨D‘™Àÿµƒ“ª÷÷∫Ï◊ÿ…´—ıªØŒÔ≥£”√◊˜—’¡œ£Æ
![]() ∑¥”¶¢Ûµƒ¿Î◊”∑Ω≥Ã Ω «______£Æ
∑¥”¶¢Ûµƒ¿Î◊”∑Ω≥Ã Ω «______£Æ
![]() ø…◊˜æªÀƺ¡£¨‘⁄ π”√ ±∑¢œ÷B≤ªƒÐ πÀ·–‘∑œÀÆ÷–µƒ–¸∏°ŒÔ≥¡Ωµ≥˝»•£¨∆‰‘≠“Ú «______£Æ
ø…◊˜æªÀƺ¡£¨‘⁄ π”√ ±∑¢œ÷B≤ªƒÐ πÀ·–‘∑œÀÆ÷–µƒ–¸∏°ŒÔ≥¡Ωµ≥˝»•£¨∆‰‘≠“Ú «______£Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øHCN «“ª÷÷æÁ∂æ–‘µƒÀ·£¨≥£Œ¬œ¬£¨0.10molL-1HCN»Ð“∫µƒpH = 3£¨œ¬¡–Àµ∑®’˝»∑µƒ «( )
A.HCN «“ª÷÷«øÀ·
B.œýÕ¨≈®∂»µƒNaCl»Ð“∫”ÎNaCN»Ð“∫£¨«∞’þµƒpH∏¸¥Û
C.‘⁄NaCN»Ð“∫÷–¥Ê‘⁄£∫c(Na+) = c(HCN) + c(CN£≠)
D.÷–∫Õœýըê˝”Î≈®∂»µƒHCl»Ð“∫”ÎHCN»Ð“∫£¨À˘œ˚∫ƒµƒNaOH»Ð“∫µƒÃª˝≤ªÕ¨
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com