
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
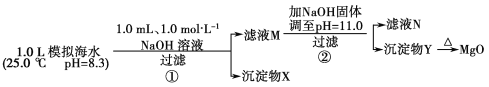
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
【答案】A
【解析】
步骤①,加入0.001molNaOH时,OH-恰好与HCO3-完全反应,生成0.001molCO32-。由于Ksp(CaCO3)<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀,滤液M中同时存在着Ca2+和Mg2+;
步骤②,当滤液M中加入NaOH固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×10-3molL-1.
根据溶度积可判断无Ca(OH)2生成,有Mg(OH)2沉淀生成,据此分析判断。
A.步骤①,从题给的条件,可知n(NaOH)=0.001mol,[即n(OH-)=0.001mol]。依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001molNaOH时,OH-恰好与HCO3-完全反应:OH-+HCO3-=CO32-+H2O,生成0.001molCO32-。由于Ksp(CaCO3)<Ksp(MgCO3),此时c(Ca2+)c(CO32-)>Ksp(CaCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀Ca2++CO32-=CaCO3↓,沉淀溶液中剩余c(Ca2+)约为0.010molL-1,c(CO32-)约为4.96×10-7 molL-1,没有MgCO3生成,所以沉淀物X为CaCO3,故A正确;
B.由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010molL-1.滤液M中同时存在着Ca2+和Mg2+,故B错误;
C.步骤②,当滤液M中加入NaOH固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×10-3molL-1,则Qc[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成。Qc[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成。又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.61×10-12,c(Mg2+)=5.61×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;
D.步骤②中若改为加入4.2gNaOH固体,则n(NaOH)=0.105mol,与0.05molMg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05molMg(OH)2,剩余0.005molOH-。由于Qc[Ca(OH)2]=c(Ca2+)×c(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D错误;
故选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g) ΔH<0,达到平衡时,下列说法正确的是
2C(g) ΔH<0,达到平衡时,下列说法正确的是
A. 加入催化剂,B的转化率增大 B. 减小容器体积,平衡不移动
C. 增大c(A),A的转化率增大 D. 降低温度,v正 增大,v逆 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2-溴丙烷制取1,2-丙二醇[(CH3CH(OH)CH2OH)]经过三步。请写出相应的化学方程式,注明反应类型。
(1)___________ 反应类型 ___________
(2)__________ 反应类型 ___________
(3)_________ 反应类型 ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
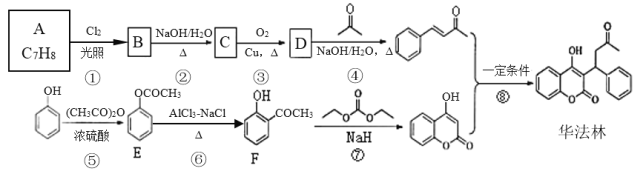
【题目】华法林(Warfarin )又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去)如图所示
回答下列问题
⑴A的名称为______,F中官能团名称为________、________。
⑵B的结构简式为_____。③的反应类型为_____,⑧的反应类型为_____。
⑶在一定条件下l mol 的华法林最多反应_______molH2
⑷写出由C 生成 D 的化学方程式为 ___________;
⑸F的同分异构体甚多,满足下列条件:①属芳香族化合物②发生银镜反应③和NaOH溶液反应,共___种,其中遇氯化铁显紫色且苯环上的一氯代物只有两种结构的结构简式_________。
⑹若D为乙醛,按框图中④同样的反应物和条件,写出生成物的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用热化学方程式表示:
①1mol N2(g)与适量O2(g)起反应,生成2 mol NO2(g),吸收68kJ热量。___________
②4g CO在氧气中燃烧生成CO2,放出9. 6kJ热量_____________________________________
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为_________________________________________________。
②又已知![]() ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 与
与![]() 混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用______。
(2)写出有关反应的化学方程式:______。
(3)实验中观察到的现象有______,能闻到刺激性气味,反应混合物成糊状。
(4)实验中的现象说明该反应为______ (填“吸热”或“放热”)反应。用NaOH溶液检验铵根离子时,反应一般需要加热,而该反应在常温下能够发生,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两元素的最外层都只有一个电子,A的原子序数等于B的原子序数的11倍,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素C与B易形成化合物B2C,该化合物常温下呈液态,则:
(1)A的原子结构示意图为____,在固态时属于___晶体。
(2)C的单质属于___晶体。B与C形成化合物B2C的化学式为___,电子式为____;它是由___键形成的___分子,在固态时属于___晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com