
【题目】将![]() 与
与![]() 混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用______。
(2)写出有关反应的化学方程式:______。
(3)实验中观察到的现象有______,能闻到刺激性气味,反应混合物成糊状。
(4)实验中的现象说明该反应为______ (填“吸热”或“放热”)反应。用NaOH溶液检验铵根离子时,反应一般需要加热,而该反应在常温下能够发生,原因是______。
科目:高中化学 来源: 题型:
【题目】科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对氢能源的研究获得了迅速发展。
(1)已知1 mol H2完全燃烧时放出285.8 kJ的热量,试写出H2燃烧的热化学方程式:_________。
(2)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是_________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(3)某学生查阅大量资料,提出下列用水制取氢气的研究方向:
①研究在水不发生化学反应的情况下制取氢气,同时释放能量。
②设法将太阳光聚焦,产生高温,使水分解产生氢气。
③寻找高效催化剂,提高水在一定条件下分解产生氢气的转化率。
④寻找特殊化学物质,用于开发廉价能源,用以分解水制取氢气
请你从上述研究方向中,选择其中不合理的项,并简述理由:不合理的是_________,理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事实的解释正确的是( )
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
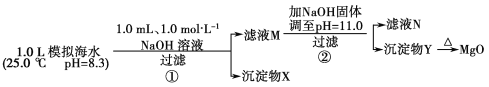
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
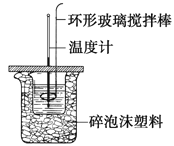
步骤一:用量筒量取50ml 0.50 molL-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 molL-1NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系![]() 部分反应中的水已略去
部分反应中的水已略去![]() .
.
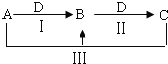
![]() 若A为氯碱工业的产品,C为厨房中的用品.
若A为氯碱工业的产品,C为厨房中的用品.
![]() 的电子式是______.
的电子式是______.
![]() 反应Ⅲ的离子方程式是______.
反应Ⅲ的离子方程式是______.
![]() 氯碱工业制备A的化学方程式是______,其中两种产物可与KI溶液反应制得一种化工原料,若消耗
氯碱工业制备A的化学方程式是______,其中两种产物可与KI溶液反应制得一种化工原料,若消耗![]() KI转移电子
KI转移电子![]() ,则三种物质间反应的离子方程式是______.
,则三种物质间反应的离子方程式是______.
![]() 若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
![]() 反应Ⅲ的离子方程式是______.
反应Ⅲ的离子方程式是______.
![]() 可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是______.
可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列有关叙述正确的是( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1mol甲烷中的氢原子被氯原子完全取代,需要氯气分子数为2NA
C.92.0g甘油(丙三醇)中含有羟基数为1.0NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是( )
A.1mol苯乙烯![]()
![]()
![]() 中含有的C=C数为4NA
中含有的C=C数为4NA
B.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
C.0.1molCnH2n+2中含有的C—C键数为0.1nNA
D.标准状况下,2.24LCHCl3含有的分子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X在元素周期表中的位置为:___,它的一种核素可测定文物年代,这种核素的符号是___。
(2)元素Y的原子结构示意图为___,Y与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法__。
(3)元素Z与元素T相比,非金属性较强的是__(用元素符号表示),下列表述中能证明这一事实的是___(填字母)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)X的最高价氧化物的结构式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com