
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是( )
A.1mol苯乙烯![]()
![]()
![]() 中含有的C=C数为4NA
中含有的C=C数为4NA
B.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
C.0.1molCnH2n+2中含有的C—C键数为0.1nNA
D.标准状况下,2.24LCHCl3含有的分子数为0.1 NA
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】用2-溴丙烷制取1,2-丙二醇[(CH3CH(OH)CH2OH)]经过三步。请写出相应的化学方程式,注明反应类型。
(1)___________ 反应类型 ___________
(2)__________ 反应类型 ___________
(3)_________ 反应类型 ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 与
与![]() 混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用______。
(2)写出有关反应的化学方程式:______。
(3)实验中观察到的现象有______,能闻到刺激性气味,反应混合物成糊状。
(4)实验中的现象说明该反应为______ (填“吸热”或“放热”)反应。用NaOH溶液检验铵根离子时,反应一般需要加热,而该反应在常温下能够发生,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两元素的最外层都只有一个电子,A的原子序数等于B的原子序数的11倍,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素C与B易形成化合物B2C,该化合物常温下呈液态,则:
(1)A的原子结构示意图为____,在固态时属于___晶体。
(2)C的单质属于___晶体。B与C形成化合物B2C的化学式为___,电子式为____;它是由___键形成的___分子,在固态时属于___晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是
A. 1s电子云呈球形,表示电子绕原子核做圆周运动
B. 钠原子由1s22s22p63p1→ls22s22p63p1时,原子释放能量,由基态转化成激发态
C. 因氧元素的电负性比氮元素的大,故氧原子的第一电离能比氮原子的大
D. 基态Fe原子的外围电子排布图为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液中由水电离出的c(H+)和c(OH-)的乘积是1×10-20,下列说法中正确的是( )
A.该溶液的溶质不可能是NaHCO3B.该溶液的pH一定是10
C.该溶液的溶质不可能是NaHSO4D.该溶液的溶质可能是正盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是__(填字母)。
A.送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B.把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C.把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D.要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
则反应CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH=__kJ·mol-1。
(3)CO2催化加氢合成二甲醚是CO2转化的一种方法,主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.2kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol-1
在一体积为1L的恒容密闭容器中,充入1molCO2与1molH2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=![]() ×100%。
×100%。
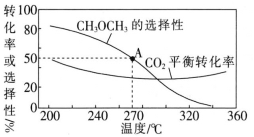
①CH3OCH3的选择性随温度的升高而降低的原因是___。
②270℃时,测得平衡时CH3OCH3的物质的量为0.1mol,此时反应Ⅰ的化学平衡常数K=__(保留2位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为___(填“阴极”或“阳极”),生成C2H4的电极反应式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com