
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X在元素周期表中的位置为:___,它的一种核素可测定文物年代,这种核素的符号是___。
(2)元素Y的原子结构示意图为___,Y与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法__。
(3)元素Z与元素T相比,非金属性较强的是__(用元素符号表示),下列表述中能证明这一事实的是___(填字母)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)X的最高价氧化物的结构式为__。
【答案】第二周期第ⅣA族 ![]() C
C ![]() 取适量溶液放入试管,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,可以证明该溶液中含有NH4+ Cl b O=C=O
取适量溶液放入试管,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,可以证明该溶液中含有NH4+ Cl b O=C=O
【解析】
T元素M层上电子数是K层上电子数的3倍,则其最外层有6个电子,且有三个电子层,为S元素;X元素最外层电子数是次外层电子数的2倍,则其有2个电子层,最外层电子数为4,为C元素;Y元素常温下单质为双原子分子,其氢化物水溶液呈碱性,则其氢化物为NH3,Y为N元素;Z元素最高正价是+7价,且为短周期元素,则Z为Cl。
(1)碳元素位于元素周期表第二周期第ⅣA族,其核素![]() C可测定文物年代;
C可测定文物年代;
(2)N元素的原子结构示意图为![]() ;铵根可以与碱共热产生氨气,氨气能使湿润的红色石蕊试纸变蓝,据此可以检验铵根,具体方法为:取适量溶液放入试管,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,可以证明该溶液中含有NH4+;
;铵根可以与碱共热产生氨气,氨气能使湿润的红色石蕊试纸变蓝,据此可以检验铵根,具体方法为:取适量溶液放入试管,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,可以证明该溶液中含有NH4+;
(3)同周期元素从左至右非金属性增强,所以非金属性Cl>S;
a.单质的熔沸点与非金属性强弱无关,故a不选;
b.非金属性越强,气态氢化物越稳定,故b选;
c.与氢氧化钠溶液反应不能说明非金属性强弱,如氧气不能与氢氧化钠溶液反应,非金属性O>S,故c不选;
综上所述选b;
(4)C元素的最高价氧化物为CO2,结构式为O=C=O。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】将![]() 与
与![]() 混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用______。
(2)写出有关反应的化学方程式:______。
(3)实验中观察到的现象有______,能闻到刺激性气味,反应混合物成糊状。
(4)实验中的现象说明该反应为______ (填“吸热”或“放热”)反应。用NaOH溶液检验铵根离子时,反应一般需要加热,而该反应在常温下能够发生,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活密切相关。
⑴氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g) + NO2 (g) =NO(g) +CO2(g) ΔH= -a kJ·mol-1(a > 0)
2CO(g) + 2NO(g) =N2(g) + 2CO2(g) ΔH = -b kJ·mol-1(b > 0)
若用CO还原NO2至N2,当消耗标准状况下3.36 L CO时,放出的热量为______ kJ(用含有a和b的代数式表示)。
⑵在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) ΔH = -57.0 kJ·mol-1测得NO2的体积分数φ(NO2)与反应时间(t)的关系如表:
N2O4(g) ΔH = -57.0 kJ·mol-1测得NO2的体积分数φ(NO2)与反应时间(t)的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 |
NO2 | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0—20min内,υ(N2O4)= ______molL-1min-1。
②上述反应中,υ(NO2)=k1c2(NO2),υ(N2O4)=k2c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为______。改变温度至T1时k1 = k2,则T1______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
⑶连二次硝酸(H2N2O2)是一种二元弱酸。25C时,向100mL 0.10 molL-1 H2N2O2溶液中加入V mL 0.10 molL-1 NaOH溶液。(已知25C时,连二次硝酸的Ka1 = 10-7,Ka2 = 10-12)
①若V =100,则所得溶液中c(H2N2O2) ______c(N2O22-)(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”),通过计算解释原因______。
”),通过计算解释原因______。
②若V =200,则所得溶液中离子浓度由大到小的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在科研、生产中有广泛应用。

(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g)![]() 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)=_________________________;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为_____________、__________________。
(2)常温下NH4+(aq)+H2O(l)![]() NH3H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3H2O的电离平衡常数K=______________________(保留三位有效数字)。
NH3H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3H2O的电离平衡常数K=______________________(保留三位有效数字)。
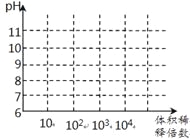
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线______________(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+______(g) ΔH2=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )
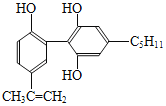
A.该分子中的所有原子有可能共平面
B.该物质与苯酚属于同系物,遇FeCl3溶液显紫色
C.滴入KMnO4(H+)溶液,观察紫色褪去,说明结构中一定存在不饱和碳碳键
D.1mol该物质分别与浓溴水、H2反应时最多消耗的Br2和H2分别为4mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是__(填字母)。
A.送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B.把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C.把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D.要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
则反应CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH=__kJ·mol-1。
(3)CO2催化加氢合成二甲醚是CO2转化的一种方法,主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.2kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol-1
在一体积为1L的恒容密闭容器中,充入1molCO2与1molH2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=![]() ×100%。
×100%。
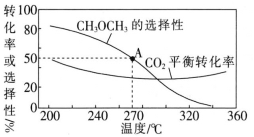
①CH3OCH3的选择性随温度的升高而降低的原因是___。
②270℃时,测得平衡时CH3OCH3的物质的量为0.1mol,此时反应Ⅰ的化学平衡常数K=__(保留2位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为___(填“阴极”或“阳极”),生成C2H4的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的18molL﹣1的浓硫酸中加入过量铜片并加热,被还原的硫酸的物质的量为0.9mol,则浓硫酸的实际体积为( )
A.等于50 mL B.大于50 mL C.等于100 mL D.大于100 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com