
【题目】某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )
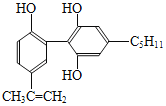
A.该分子中的所有原子有可能共平面
B.该物质与苯酚属于同系物,遇FeCl3溶液显紫色
C.滴入KMnO4(H+)溶液,观察紫色褪去,说明结构中一定存在不饱和碳碳键
D.1mol该物质分别与浓溴水、H2反应时最多消耗的Br2和H2分别为4mol、7mol
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列有关叙述正确的是( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1mol甲烷中的氢原子被氯原子完全取代,需要氯气分子数为2NA
C.92.0g甘油(丙三醇)中含有羟基数为1.0NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是
A.H2Y的电离方程式:H2Y![]() 2H+ + Y2-
2H+ + Y2-
B.HY- 水解的离子方程式:HY- + H2O![]() H2Y + OH-
H2Y + OH-
C.该酸式盐溶液中离子浓度大小关系:c(Na+) > c(HY-)>c(OH-) >c(H+)
D.该酸式盐溶液中微粒浓度关系:c(H+)+c(H2Y) = c(OH-)+c(Y2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X在元素周期表中的位置为:___,它的一种核素可测定文物年代,这种核素的符号是___。
(2)元素Y的原子结构示意图为___,Y与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法__。
(3)元素Z与元素T相比,非金属性较强的是__(用元素符号表示),下列表述中能证明这一事实的是___(填字母)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)X的最高价氧化物的结构式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为_____________。
(2)CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
键 | H-H | C=O | C=C | O-H | C-H |
键能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
则a=________。
(3)T℃时。在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。


(4) 工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:

①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
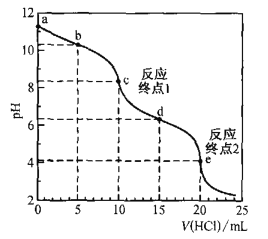
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
![]()
(1) 写出有机物(a)的系统命名法的名称___________________。
(2) 有机物(a)有一种同分异构体,试写出其结构简式__________________。
(3) 上述有机物中与(c)互为同分异构体的是________(填代号)。
(4) 任写一种与(e)互为同系物的有机物的结构简式____________。
(5) 上述有机物中不能与溴反应并使其褪色的有________(填代号)。
(6) (a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷石膏是湿法生产磷酸的固体废弃物,用磷石膏生产硫酸或硫,既可减少对环境的污染又可使资源循环利用。回答下列问题:
(1)用焦炭、硫磺等均可还原磷石膏。已知下列反应:
I .CaSO4(s)+2C(s)=CaS(s) +2CO2(g) H1=+226kJ·mol—1
II.3CaSO4 (s)+CaS(s)=4CaO(s) +4SO2(g) H2=akJ·mol—1
III. 3CaS(s)+CaSO4 (s) =4CaO(s) +4S(s) H3=bkJ·mol—1
①反应(I)能在______(填“低温”“高温”或“任何温度”)下自发进行。
②用硫磺还原CaSO,反应为2CaSO4(s)+S(s)=2CaO(s)+3SO2 (g),其△H=___ kJ·mol—1(用含a、b的代数式表示)。
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3![]() CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=________[已知:Ksp (CaCO3)=2. 5×10—9,Ksp(CaSO4)=3. 2×10—7],为了提高CaSO4的平衡转化率,可采取的措施是_______________________________。(写一条)。
CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=________[已知:Ksp (CaCO3)=2. 5×10—9,Ksp(CaSO4)=3. 2×10—7],为了提高CaSO4的平衡转化率,可采取的措施是_______________________________。(写一条)。
(3)一氧化碳还原CaSO4可发生下列反应,其lgKp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。
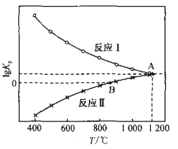
I .SO2(g)+3CO(g) ![]() 2CO2(g)+COS(g)
2CO2(g)+COS(g)
II .CaSO4(s)+CO(g) ![]() CaO(s)+CO2 (g)+SO2(g)
CaO(s)+CO2 (g)+SO2(g)
①△H>0的反应是_______(填“I”或“II”)。
②在交点A处,气体分压间满足的关系是:p (COS) =_____
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是___________(填字母)。
a. 2v(CO) 正=3v(CO2)正
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d. ![]() 的值不再随时间而变化
的值不再随时间而变化
④若在1.0 L的恒容密闭容器中加入1mol CaSO4,并充入1molCO,只发生反应II。在B点时气体总压强为1 MPa,则此时CaSO4转化率为________(已知![]() 1.41).
1.41).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com