
【题目】室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
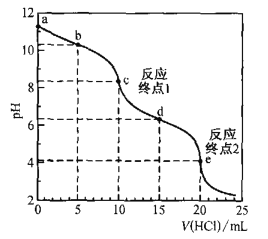
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
【答案】C
【解析】
A. 当加入10mL盐酸时,达到反应终点1,发生了反应:Na2CO3+HCl=NaHCO3+NaCl,即恰好生成了NaHCO3,n(Na2CO3)=n(HCl)=0.01L×0. 100 mol·L—1=0.001mol,所以a点溶液中c(Na2CO3)=![]() =0.020 mol·L—1,正确;
=0.020 mol·L—1,正确;
B. b点加入5mL盐酸,此时溶液中的溶质为等物质的量浓度的Na2CO3、NaHCO3和NaCl,c(Na+)最大,CO32-水解程度大于HCO3-,所以溶液中c(Na+)>c(HCO3— )>c(CO32—),正确;
C. c点溶液中有电荷守恒:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)+c(Cl—),错误;
D. e点时,溶液中溶质为NaCl和H2CO3,根据碳守恒,c(H2CO3)=![]() =
=![]() mol/L,溶液的pH为4,所以H2CO3的一级电离平衡常数Kal=
mol/L,溶液的pH为4,所以H2CO3的一级电离平衡常数Kal=![]() =
=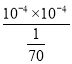 =7×10-7,故H2CO3的一级电离平衡常数的数量级为10—7,正确;
=7×10-7,故H2CO3的一级电离平衡常数的数量级为10—7,正确;
故选C。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】A、B两元素的最外层都只有一个电子,A的原子序数等于B的原子序数的11倍,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素C与B易形成化合物B2C,该化合物常温下呈液态,则:
(1)A的原子结构示意图为____,在固态时属于___晶体。
(2)C的单质属于___晶体。B与C形成化合物B2C的化学式为___,电子式为____;它是由___键形成的___分子,在固态时属于___晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在科研、生产中有广泛应用。

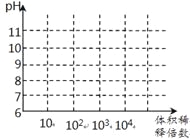
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g)![]() 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)=_________________________;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为_____________、__________________。
(2)常温下NH4+(aq)+H2O(l)![]() NH3H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3H2O的电离平衡常数K=______________________(保留三位有效数字)。
NH3H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3H2O的电离平衡常数K=______________________(保留三位有效数字)。
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线______________(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+______(g) ΔH2=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )
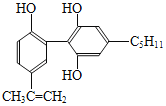
A.该分子中的所有原子有可能共平面
B.该物质与苯酚属于同系物,遇FeCl3溶液显紫色
C.滴入KMnO4(H+)溶液,观察紫色褪去,说明结构中一定存在不饱和碳碳键
D.1mol该物质分别与浓溴水、H2反应时最多消耗的Br2和H2分别为4mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol·L-1·s-1。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___100℃(填“大于”或“小于”)。
(3)计算温度T时反应的平衡常数K2___(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是__(填字母)。
A.送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B.把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C.把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D.要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
则反应CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH=__kJ·mol-1。
(3)CO2催化加氢合成二甲醚是CO2转化的一种方法,主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.2kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol-1
在一体积为1L的恒容密闭容器中,充入1molCO2与1molH2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=![]() ×100%。
×100%。
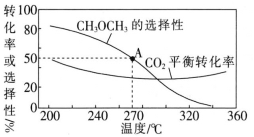
①CH3OCH3的选择性随温度的升高而降低的原因是___。
②270℃时,测得平衡时CH3OCH3的物质的量为0.1mol,此时反应Ⅰ的化学平衡常数K=__(保留2位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为___(填“阴极”或“阳极”),生成C2H4的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是产生和收集气体的实验装置,该装置适合于( )

A.用浓硝酸与Cu反应制取NO2B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2D.用NH4Cl和Ca (OH)2反应制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不能正确表达反应颜色变化的是( )
A.向氯水中通入SO2气体,溶液浅黄绿色消失:Cl2 + SO2 + 2 H2O = 4H+ + 2Cl- + SO42-
B.向AgNO3溶液中加入一定量HCl溶液,后加入Na2S溶液,白色沉淀变黑色:2AgCl + S2- = Ag2S + 2Cl-
C.向氢氧化铁胶体中加入HI酸溶液,首先出现红褐色沉淀,后沉淀消失,溶液变为黄色:2Fe(OH)3 + 6H+ + 2I- = 2Fe2+ + I2 + 6H2O
D.向CrO42-中加入H2SO4溶液,颜色由黄色变为橙色:2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com