
【题目】科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对氢能源的研究获得了迅速发展。
(1)已知1 mol H2完全燃烧时放出285.8 kJ的热量,试写出H2燃烧的热化学方程式:_________。
(2)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是_________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(3)某学生查阅大量资料,提出下列用水制取氢气的研究方向:
①研究在水不发生化学反应的情况下制取氢气,同时释放能量。
②设法将太阳光聚焦,产生高温,使水分解产生氢气。
③寻找高效催化剂,提高水在一定条件下分解产生氢气的转化率。
④寻找特殊化学物质,用于开发廉价能源,用以分解水制取氢气
请你从上述研究方向中,选择其中不合理的项,并简述理由:不合理的是_________,理由是___________。
【答案】H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ/mol C ①③ ①:水分子中不含氢气分子,不可能在不发生化学反应的情况下得到氢气,且水分解是吸热反应(或③:催化剂能提高水分解产生氢气的反应速率,但不能提高水的转化率)
O2(g)=H2O(l) △H=-285.8 kJ/mol C ①③ ①:水分子中不含氢气分子,不可能在不发生化学反应的情况下得到氢气,且水分解是吸热反应(或③:催化剂能提高水分解产生氢气的反应速率,但不能提高水的转化率)
【解析】
(1)书写热化学方程式时反应热要与反应的物质相对应,且要注明物质的聚集状态,据此书写热化学方程式;
(2)从开发较经济且资源可持续利用的制取氢气的方法要从能源消耗分析;
(3)①根据物质的分类、含有的元素、能量转化、物理变化与化学变化概念特点分析;
②用水制取新能源氢气,需吸收能量,设法将太阳光聚焦,产生高温使水分解产生氢气;
③根据概念及在反应中催化剂的作用分析;
④寻找特殊的化学物质,改变水分解的化学反应速率,用于开发廉价能源,以分解水制取氢气。
(1)1 mol H2完全燃烧产生1 mol液态H2O时放出285.8 kJ的热量,则其燃烧的热化学方程式为H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ/mol;
O2(g)=H2O(l) △H=-285.8 kJ/mol;
(2)A. 电解水需要大量的电能,不符合廉价的要求,A不符合题意;
B. 锌与稀硫酸反应,需要消耗大量的锌和硫酸,不符合廉价的要求,B不符合题意;
C. 光解海水,可充分利用光能,廉价而又低碳,符合要求,C符合题意;
故合理选项是C;
(3)①水是纯净物,不是混合物,水是化合物,其中含有H、O两种元素,而H2是单质,因此由水制取氢气的变化是由化合物转化为单质,发生的是化学变化,且水分解反应是吸热反应,故①不可行;
②用水制取新能源氢气,水在高温下也可以发生分解反应,设法将太阳光聚焦,产生高温使水分解产生氢气,②可行;
③催化剂,能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生改变,故寻找高效催化剂,使水分解产生氢气的速率加快,但催化剂不能使化学平衡发生移动,因此不能改变水分解的转化率,③不可行;
④寻找特殊的化学物质,改变水分解的化学反应速率,用于开发廉价能源,以分解水制取氢气,④可行;
综上所述可知:不可行的措施是①③。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在温度一定的条件下,N2(g)+ 3H2(g)![]() 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为
2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
A.新的平衡体系中,N2的浓度小于2c mol·L1大于c mol·L1
B.新的平衡体系中,NH3的浓度小于2c mol·L1大于c mol·L1
C.新的平衡体系中,混合体的平均摩尔质量大于![]()
D.新的平衡体系中,气体密度是原平衡体系的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
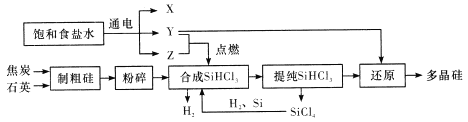
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g) ΔH<0,达到平衡时,下列说法正确的是
2C(g) ΔH<0,达到平衡时,下列说法正确的是
A. 加入催化剂,B的转化率增大 B. 减小容器体积,平衡不移动
C. 增大c(A),A的转化率增大 D. 降低温度,v正 增大,v逆 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是:
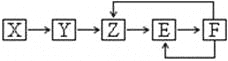
A. X可能是一种氢化物
B. 若Y为单质,Y生成Z属于化合反应
C. E可能是一种有色气体
D. F中M元素的化合价可能为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是由短周期元素组成的常见物质或微粒,在中学化学中有许多物质或微粒能满足下列相互转化关系:甲![]() 乙
乙![]() 甲.下列说法正确的是
甲.下列说法正确的是
A.甲有可能是![]() 也有可能是
也有可能是![]()
B.若乙为无色无味气体,则甲一定是![]()
C.若甲是具有刺激性气味的气体,则甲、乙具有相同的电子数
D.若甲、乙均为离子,甲、乙两种离子在同一溶液中一定不能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)
下列有关说法不正确的是

A. 该电池的反应式为Li1-xMnO2+LixC6=LiMnO2+C6
B. K与M相接时,A是阳极,发生氧化反应
C. K与N相接时,Li+由A极区迁移到B极区
D. 在整个充、放电过程中至少存在3种形式的能量转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2-溴丙烷制取1,2-丙二醇[(CH3CH(OH)CH2OH)]经过三步。请写出相应的化学方程式,注明反应类型。
(1)___________ 反应类型 ___________
(2)__________ 反应类型 ___________
(3)_________ 反应类型 ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 与
与![]() 混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用______。
(2)写出有关反应的化学方程式:______。
(3)实验中观察到的现象有______,能闻到刺激性气味,反应混合物成糊状。
(4)实验中的现象说明该反应为______ (填“吸热”或“放热”)反应。用NaOH溶液检验铵根离子时,反应一般需要加热,而该反应在常温下能够发生,原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com