
(8分)实验室中需要220mL0.5mol/L H2SO4,现用98%浓硫酸(密度为1.84g/cm3)稀释配制。
(1)本实验室中需要的仪器是 。
(2)要将浓硫酸在 中稀释,稀释时的操作方法是 。
(3)必须将稀释后的硫酸 后再移液,原因是 ,否则,所配制的稀硫酸浓度会 (偏高、偏低、无影响)。
(8分,每空1分。)(1) 250mL容量瓶,10mL量筒,烧杯 。(每1仪器1分)
(2)烧杯;先将水注入烧杯中,再慢慢注入浓硫酸,并及时搅拌和冷却。
 (3)冷却至室温 , 浓硫酸溶于水放热 , 偏高
(3)冷却至室温 , 浓硫酸溶于水放热 , 偏高
【解析】
试题分析:(1)实验室没有220mL的容量瓶,则需要配制250mL稀硫酸,因此需要浓硫酸的体积是 。浓硫酸需要量筒量取,在烧杯中稀释,稀释需要玻璃棒,然后转移至250mL容量瓶,定容需要胶头滴管,所以本实验室中需要的仪器是 250mL容量瓶,10mL量筒,烧杯。
。浓硫酸需要量筒量取,在烧杯中稀释,稀释需要玻璃棒,然后转移至250mL容量瓶,定容需要胶头滴管,所以本实验室中需要的仪器是 250mL容量瓶,10mL量筒,烧杯。
(2)要将浓硫酸在烧杯中稀释。由于浓硫酸溶于水放热,且浓硫酸的密度对于空气,所以稀释时的操作方法是先将水注入烧杯中,再慢慢注入浓硫酸,并及时搅拌和冷却。
(3)由于浓硫酸溶于水放热 ,所以必须将稀释后的硫酸冷却后再移液。否则根据热胀冷缩可知容量瓶中溶液的体积偏小,则根据c=n÷V可知所配制的稀硫酸浓度会偏高。
考点:考查一定物质的量浓度的配制
考点分析: 试题属性

科目:高中化学 来源:2014-2015学年广东省中山市高三下学期第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
下列关于常见有机物的说法不正确的是
A.乙烯和苯都能与溴水反应
B.乙酸和油脂都能与氢氧化钠溶液反应
C.糖类和蛋白质都是人体重要的营养物质
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长望浏宁四县高三一模考试化学试卷(解析版) 题型:填空题
【化学-选修5有机化学基础】(15分)
咖啡酸苯乙酯 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。

请回答下列问题:
(1)A分子中的官能团是_______________________________。
(2)高分子化合物M的结构简式是_______________________________。
(3)写出A→B反应的化学方程式:__________________________________。
(4)A→B的反应类型为__________;E→M的反应类型为________;B→C的反应类型为__________。
(5)A的同分异构体有很多种,其中同时符合下列条件的同分异构体有________种。
①苯环上只有两个取代基 ②能发生银镜反应
③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省七市教科研协作体高三3月联考化学试卷(解析版) 题型:填空题
各种污染日趋严重,防止污染、改善水质的主要措施是对废气,废水进行处理.
Ⅰ.已知:汽车尾气处理的反应之一:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下左图所示.
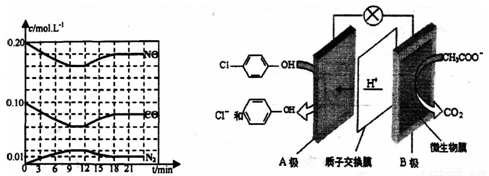
①该反应第一次达到平衡时的平衡常数为__________。
②第12min时改变的条件是___________(填“升温”、“降温”),判断的依据是____________________。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”).
Ⅱ.含有乙酸钠和对氯苯酚 的酸性废水,可利用微生物电池法除去,其原理如上右图所示
的酸性废水,可利用微生物电池法除去,其原理如上右图所示
①B是电池的______极(填“正”或“负”);
②酸性条件下,A极的电极反应式为______________________________。
③设电极两边溶液分别为1L,反应一段时间后,A极区溶液的pH从4变到1,此过程中处理的乙酸钠的质量为_________g 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省七市教科研协作体高三3月联考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA
B.10g46%的乙醇水溶液中所含氢原子数目为1.2NA
C.高温下,0.2mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA
D.25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.02NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是
A.1:3 B.2:3 C.1:1 D. 4:3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是
A.Na+、Ag+、CO32-、Cl- B.K+、 Ba2+、 SO42-、Cl-
C.Na+、K+、CO32-、Cl- D.Na+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
利用下列图示进行相应实验,能达到目的的是

A.用图1可萃取碘水中的碘
B.用图2可除去NO2中的NO
C.用图3制取并收集干燥纯净的NH3
D.用图4配制100mL一定物质的量浓度的稀硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高二上学期学期期末化学试卷(解析版) 题型:填空题
(14分)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:① Z的原子序数为29,而Q、R、X、Y均为短周期主族元素;② R原子有3个未成对电子;③ Q、X原子p轨道的电子数分别为2和4;④ Y原子价电子(外围电子)排布为msnmpn。请回答下列问题:
(1)R的氢化物RH3中R采取______杂化,其键角_____109°28′(选填“>”、“=”或者“<”)。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是(选填字母代号)_____。
a.稳定性:甲>乙;沸点:甲>乙
b.稳定性:甲>乙;沸点:甲<乙
c.稳定性:甲<乙;沸点:甲<乙
d.稳定性:甲<乙;沸点:甲>乙
(3)下列与H2X分子互为等电子体的微粒有(选填字母代号) 。
a.CH4 b.H2S c.NO2 d.NH2-
(4)由X和Y形成的化合物属于________晶体(填晶体类型),30 g该晶体中有_____mol共价键。
(5)Z是 (填元素符号),它位于周期表的 区,其晶体的三维堆积模型见下图,

称之为面心立方最密堆积,其配位数为 。Z2+的外围电子排布式是____________。1个Z2+与4个RH3以配位键结合形成_________________离子(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com