
【题目】双氧水是常见的氧化剂、消毒剂,一种制取双氧水的流程如下:
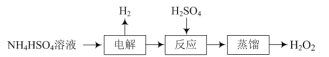
(1)“电解”后生成(NH4)2S2O8,该反应的化学方程式为______。
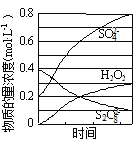
(2)“反应”中部分物质的浓度变化如图所示,该反应的离子方程式为______。
(3)双氧水中H2O2的含量可以用酸性KMnO4溶液来测定,测定时MnO![]() 被还原成Mn2+,测定反应的离子方程式为______。
被还原成Mn2+,测定反应的离子方程式为______。
(4)pH=6时,(NH4)2S2O8溶液与足量MnSO4反应有MnO2沉淀生成,过滤后所得滤液中含硫微粒均为SO42-,该反应的离子方程式为______。
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】关于 下列结论正确的是
下列结论正确的是
A. 该有机物分子式为C13H16
B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线
D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
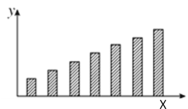
A. 若X轴为原子序数,y轴表示的可能是第一电离能
B. 若X轴为原子序数,y轴表示的可能是原子半径
C. 若X轴为最高正化合价,y轴表示的可能是电负性
D. 若X轴为族序数,y轴表示的可能是0.1mol/L最高价氧化物对应水化物溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
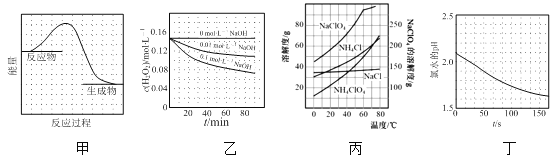
A.图甲表示某反应过程中的能量变化曲线,可推知该反应是吸热反应
B.图乙表示70℃时不同碱性条件下H2O2的浓度随时间变化的曲线,可推知溶液碱性越强,H2O2分解速率越慢
C.图丙表示部分物质的溶解度随温度变化的曲线,可推知20℃时向含a mol NaClO4的饱和溶液中加入a mol NH4Cl固体会有NH4ClO4固体析出
D.图丁表示光照下氯水的pH随时间的变化曲线,可推知光照后溶液中Cl2浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、硫、氯元素在科研与生产中也有许多重要的用途。请回答下列问题:
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式________ 。
(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为___________。但NCl5不存在,其原因是___________________。
(3)N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式_______________________。
(4)①请推测①HC1O4、②H5IO6[可写成(HO)5IO]、③HIO4三种物质的酸性由强到弱的顺序为_________(填序号)。
②已知一定条件下发生反应:Na2O+NaCl=Na3OCl,该反应过程中破坏和形成的化学键有_________。
(5)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:____;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为_____。

(6)多原子分子中各原子若在同一平面,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键。分子中的π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)![]() 2HI(g);△H=-9.48 kJ·mol-1
2HI(g);△H=-9.48 kJ·mol-1
(ii)I2(S)+ H2(g)![]() 2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.反应(i)的产物比反应(ii)的产物稳定
C.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
(2)通过K值的计算,(1)中的反应是_________反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(g),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2 | H2O | CO | H2 |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_______________________。
②在3~4min之间,反应处于___________状态(填“平衡”或“非平衡”)。
③第6min时,平衡向_________方向移动,可能的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN度液为主要原料制备黄血盐的流程如下:
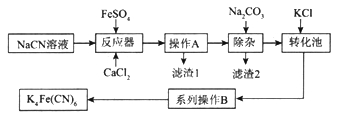
请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。
(3)系列操作B为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
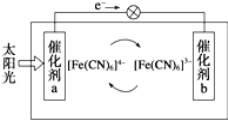
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com