
【题目】(15分)Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞试液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞试液变红是因为 ,红色褪去的可能原因是 。
②加入MnO2反应的化学方程式为 。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
步骤1:按图示组装仪器(图中夹持仪器省略),检查气密性,装入药品;
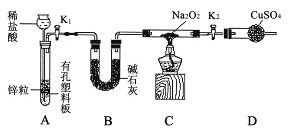
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称 ;B装置的作用是 。
②必须检验氢气纯度的原因是 。
③设置装置D的目的是 。
④你得到的结论是 (若能反应请用化学方程式表示)。
【答案】(1)①生成了碱(NaOH) 反应生成的H2O2具有漂白作用(2分)
②![]() (2分)
(2分)
(2)①长颈漏斗 (1分)吸收氢气中的杂质气体(水蒸气、氯化氢等)(2分)
②防止空气与氢气混合加热爆炸 (2分)
③检验有无水生成 (2分)
④2 Na2O2+2H2O=4NaOH +O2↑
【解析】试题分析:(1)①过氧化钠和水反应生成氢氧化钠是碱,碱遇酚酞变红;红色褪去的可能原因是过氧化钠和水反应生成的过氧化氢具有氧化性,能氧化有色物质,故答案为:过氧化钠和水反应生成碱氢氧化钠;反应生成的H2O2具有漂白作用;
②过氧化氢在二氧化锰做催化剂分解生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)①分析装置图和实验步骤可知,盛盐酸的仪器为长颈漏斗;B装置是吸收氢气中的杂质气体,除去氢气中的水蒸气等,故答案为:长颈漏斗;吸收氢气中的杂质气体;
②氢气是可燃性气体混有空气易点燃发生爆炸,验纯防止空气与氢气混合加热爆炸,故答案为:防止空气与氢气混合加热爆炸;
③D装置是防止空气中的二氧化碳和水蒸气进入C影响实验验证,故答案为:防止空气中的二氧化碳和水蒸气进入C装置和过氧化钠反应影响实验验证;
④实验现象分析可知过氧化钠变为白色固体,硫酸铜不变蓝色证明无水生成,证明氢气和过氧化钠反应生成氢氧化钠,反应的化学方程式为Na2O2+H2![]() 2NaOH,故答案为:氢气和过氧化钠反应生成氢氧化钠,Na2O2+H2
2NaOH,故答案为:氢气和过氧化钠反应生成氢氧化钠,Na2O2+H2![]() 2NaOH。
2NaOH。


科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是
①检验自来水是否含氯离子 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸 ④白酒中是否含甲醇
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
B. 足量的Fe在Cl2中燃烧生成FeCl2和FeCl3
C. 先后将等物质的量的Fe2O3和Fe分别溶于同一稀盐酸时无气体放出
D. Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3,在给定的条件下能实现转化
无水FeCl3,在给定的条件下能实现转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有七叶树内酯,其结构简式为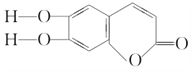 ,具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
,具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
A. 3 mol、2 mol B. 3 mol、3 mol C. 2 mol、2 mol D. 3 mol、4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据査危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是_______。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,可能发生氧化还原反应,下列反应可能发生的是_________。
A. NH4NO3![]() N2 +O2+H2O B. NH4NO3
N2 +O2+H2O B. NH4NO3![]() NH3+HNO3
NH3+HNO3
C. NH4NO3![]() O2 + HNO3 + H2O D. NH4NO3
O2 + HNO3 + H2O D. NH4NO3![]() N2 + HNO3+ H2O
N2 + HNO3+ H2O
E. NH4NO3 ![]() N2+ NH3+ H2O F. NH4NO3
N2+ NH3+ H2O F. NH4NO3![]() N2O+ H2O
N2O+ H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
①H2O2 处理法:NaCN + H2O2 ——N2↑+X + H2O,推测X的化学式为_______________。
②NaClO 处理法:aCN-+bC1O-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O方程式中e:f的值为____(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与 NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL (设其中CN-的浓度为0.2 mol·L-1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:________________________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过
程如图:

已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、_________(填操作名称);步骤④在实验室中常将试剂置于___________(填仪器名称)中加强热。
(2)步骤③中加入热水的作用是__________________________________。
(3)步骤④中硫酸亚铁晶体(FeSO47H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式______________________________________________________________。
(4)步骤②所得到的硫酸亚铁晶体(FeSO47H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeOFeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO47H2O的物质的量应为废水中六价铬(相当于CrO3)的物质的量的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 还有少量Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: 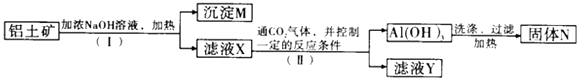
(1)Ⅰ和Ⅱ步骤中分离滤液和沉淀的操作是 .
(2)沉淀M中除含有泥沙外,一定还含有;固体N是 .
(3)滤液X中,含铝元素的溶质的化学式为;它属于(填“酸”“碱”或“盐”)类物质.
(4)实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取Al(OH)3 . 发生反应的离子方程式为
(5)向滤液Y中滴加足量盐酸,发生的离子反应方程式为(若没有反应发生,则填“无”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)写出反应②的化学方程式:_____________________________。
(2)反应③的反应类型为____________。
(3)C的结构简式为____________。
(4)C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)____________、____________。
(5)反应________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O, 则下列说法正确的是( )
2PbSO4+2H2O, 则下列说法正确的是( )
A. 放电时:当外电路通过1mol的电子时,理论上负极板的质量增加了151.5g
B. 充电时:阳极反应是PbSO4-2e-+2H2O = PbO2+SO42-+4H+
C. 放电时:正极反应是Pb-2e-+SO42-= PbSO4
D. 充电时:铅蓄电池的阴极应与电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com