
| A. | 除去CuSO4溶液中的Fe(SO4)3,加入足量CuO粉末,充分搅拌过滤 | |
| B. | 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多 | |
| C. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| D. | 铁管道与直流电源正极相连,可缓解管道腐蚀 |
分析 A.CuO可促进铁离子的水解;
B.烧碱碱性强,具有腐蚀性;
C.石灰水的浓度太小,不利于制备漂白粉;
D.与正极相连为阳极,失去电子加快腐蚀.
解答 解:A.CuO可促进铁离子的水解转化为沉淀,则加入足量CuO粉末,充分搅拌过滤可除杂,故A正确;
B.烧碱碱性强,具有腐蚀性,不能用于治疗胃酸过多,而小苏打、氢氧化铝均可用于治疗胃酸过多,故B错误;
C.石灰水的浓度太小,不利于制备漂白粉,则工业生产中,常将氯气通入石灰乳中制取漂白粉,故C错误;
D.与正极相连为阳极,失去电子加快腐蚀,则铁管道与直流电源阴极相连,可缓解管道腐蚀,故D错误;
故选A.
点评 本题考查物质组成、结构与性质,为高频考点,把握物质的性质、发生的反应及性质与用途的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ba2+、OH-、NO${\;}_{3}^{-}$、Na+ | B. | K+、Cu2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、SO42- | D. | Mg2+、SO42-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
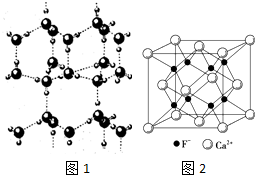 (1)下列分子中,属于平面型构型的有CD.
(1)下列分子中,属于平面型构型的有CD.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. 、
、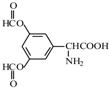 .
.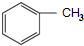 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 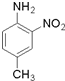 的合成路线流
的合成路线流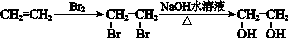
 呈弱碱性,易被氧化
呈弱碱性,易被氧化 的合成路线流程图:
的合成路线流程图: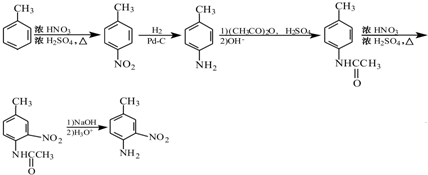 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①③④⑤⑨ | C. | ②④⑤⑦⑪ | D. | ②④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(0H)2溶液中滴H2SO4溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 明矾溶液中加氢氧化钡溶液,使其产生沉淀的物质的量达最大值:Al3++2SO42-+2Ba+4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| D. | 向100mL0.1mol/L的FeBr2溶液中通入0.012molCl2:10Fe2++14Br-+12Cl2═10Fe3++7Br2+24Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com