
常温时,下列各溶液中有关粒子浓度的说法正确的是( )
| A.pH=5的NaHSO3溶液:c(HSO3-) > c(SO32-)> c(H2SO3) |
| B.pH=3的盐酸跟pH=11的氨水等体积混合: c(H+)>c(OH-) |
| C.pH<7的CH3COONa和CH3COOH的混合溶液 c(Na+)> c(CH3COO-)> c(H+)>c(OH-) |
| D.pH=12的NaOH溶液中:c(OH-)水电离=1.0×10-12 mol/L |
AD
解析试题分析: A项的NaHSO3溶液pH=5,溶液显酸性,说明HSO3- 的电离大于水解,所以c(HSO3-) > c(SO32-)> c(H2SO3),A正确;B项pH=3的盐酸与pH=11的氨水有c(H+)=c(OH-),所以等体积混合氨水过量,所以混合后溶液显碱性c(H+)<c(OH-),B错误;CH3COONa和CH3COOH的混合溶液中有离子电荷守恒式c(Na+)+ c(H+) = c(CH3COO-)+c(OH-),由于pH<7,所以c(H+)<c(OH-),因此有c(Na+)< c(CH3COO-),故C错误;pH=12的NaOH溶液中水的电离受到抑制,但利用水的离子积可计算得溶液中的c(H+)=1.0×10-12 mol/L,所以c(OH-)水电离= c(H+)=1.0×10-12 mol/L,所以D正确。故选AD。
考点:本题考查的是混合溶液中离子浓度大小比较。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:单选题
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三点溶液中水的电离程度a>b>c |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.100℃时,KW =10-12,此温度下PH =6的溶液一定显酸性 |
| B.25℃时,0.1mol/L的NaHSO3溶液pH =4,说明HSO3-在水溶液中只存在电离 |
| C.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 |
| D.25℃时,10mL 0.1mol/L CH3COOH溶液与5mL 0.1mol/L NaOH溶液混合,所得溶液中有 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-) )与pH的变化关系如图所示,则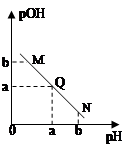
| A.N点所示溶液中c(H+) < c(OH-) |
| B.M点所示溶液导电能力强于Q点 |
| C.M点水的电离程度大于N点 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]
B.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH="1"
D.室温下,0.1mol?L-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是 ( )
| A.反应后溶液中c(Na+)=2c(SO42—) |
| B.a/2mol>沉淀的物质的量>0 |
| C.沉淀的质量=49a g |
| D.溶液中n(SO42—)=a/2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
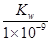 mol/L
mol/L查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com