
【题目】为了除去氯化钠溶液中的少量溴化钠,常用方法是往溶液中加入少量氯水,发生反应:2NaBr+Cl2===2NaCl+Br2,然后加入苯或四氯化碳,经振荡、静置、分液,可得到氯化钠溶液。下列分析判断中不正确的是( )
A.加入苯或四氯化碳的操作叫萃取
B.苯层在上层或四氯化碳层在下层
C.可以用酒精代替苯或四氯化碳
D.氯单质置换了溴单质
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
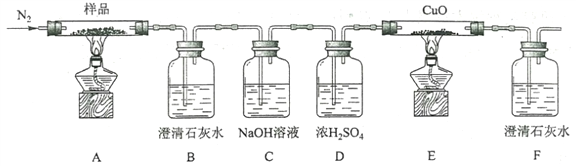
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为________________。组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为____________________。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是____________、___________, 1个氯磺酰氰酯分子中含有σ键的数目为______________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为_________________。
(3)ClO4-的空间构型为__________________。
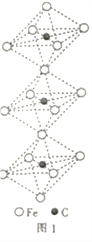
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为________________。
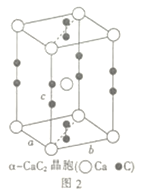
(5)电石(CaC2)是制备氯化氰(ClCN)的重要原料。四方相碳化钙(CaC2)的晶胞结构如上图2所示,其晶胞参数分别为a、b、c,且a=b,c=640pm。已知四方相碳化钙的密度为1.85g·cm-3,[C≡C]2-中键长为120pm,则成键的碳原子与钙原子的距离为________pm和_______pm。(设阿伏加德罗常数的数值为6×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生配制0.1 mol·L-1氢氧化钠溶液 100 mL,下列操作会造成实际浓度偏高的是( )
A.空盘时天平指针指向左边
B.把烧碱放在滤纸上称量
C.定容时俯视刻度线
D.使用部分变质的烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中对于相关物质的分类全部正确的一组是( )
编号 | 碱性氧化物 | 酸性氧化物 | 非电解质 | 强电解质 |
A | Na2O | CO2 | NH3 | 醋酸铵 |
B | Na2O2 | SO2 | 乙醇 | NaHCO3 |
C | Al2O3 | SO3 | CO2 | Fe(OH)3 |
D | Fe3O4 | CO | Cl2 | NH4Cl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是
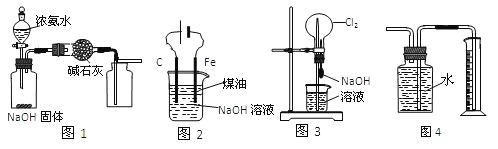
A. 用图1装置制取干燥纯净的NH3
B. 用图2装置制备Fe(OH)2并能较长时间观察其颜色
C. 用图3装置可以完成“喷泉”实验
D. 用图4装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向60 mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表:

下列有关说法不正确的是
A. 混合前,BaCl2溶液的物质的量浓度为0.10 mol·L-1
B. 混合前,Na2SO4溶液的物质的量浓度为0.15 mol·L-1
C. 3号实验中沉淀的质量x为1.398 g
D. 完全沉淀60 mL Na2SO4溶液消耗BaCl2溶液的体积为80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验。(a、b 为弹簧夹,其他装置略去)
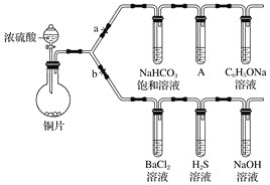
(一)验证酸性的相对强弱:碳酸>苯酚。(已知酸性:亚硫酸 >碳酸)
(1)铜与浓硫酸反应的化学方程式是________________________________,装置A中的足量的试剂是______________。
(2)连接仪器、________、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。能说明碳酸的酸性比苯酚酸性强的实验现象是:________________。
(二)验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a。能验证SO2具有氧化性的化学方程式是________________。
(4)若过量的SO2通入NaOH溶液中,其化学方程式是:________________。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式分别是________________,________________。
(6)写出其中SO2显示还原性并生成白色沉淀的总的离子方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com