
����Ŀ������������Ԫ��X��Y��R��M��ԭ������������������ֻ��R���ڽ���Ԫ�أ���X��Y��R�����һ�ֻ�����Q����298Kʱ��0.1mol��L��1 Q��Һ��AG(���)��lg![]() ����12����X��M��ɵĻ�����XM��ǿ����ʡ�����˵����ȷ����
����12����X��M��ɵĻ�����XM��ǿ����ʡ�����˵����ȷ����
A. Y��R��M����Ԫ���γɵļ����Ӱ뾶��r(M)>r(R)>r(Y)
B. M���������Ӧ��ˮ����һ����ǿ��
C. R�ֱ���X��Y��M��ɵĶ�Ԫ�������ж��������Ӽ�
D. ������RYX��RMY��������ˮ�ĵ���
���𰸡�C
������������������Ԫ��X��Y��R��M��ԭ������������������ֻ��R���ڽ���Ԫ�أ���X��Y��R�����һ�ֻ�����Q��298Kʱ��0.1molL-1Q��Һ��AG(���)=lg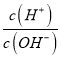 =-12����c(H+)=c(OH-)��10-12�����ˮ�����ӻ���֪c(OH-)c(OH-)��10-12=10-14����c(OH-)=0.1mol/L��˵��Q��ҺΪһԪǿ���QΪNaOH������ԭ��������С��֪XΪH��YΪO��RΪNaԪ�أ���X��M��ɵĻ�����XM��ǿ����ʣ�M��ԭ����������Na����MΪClԪ�ء�A��RΪNa��YΪO��MΪClԪ�أ����ӵĵ��Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ���ͬʱ�����ӵĺ˵����Խ�����Ӱ뾶ԽС��������Ӱ뾶��M��Y��R����A������B��MΪClԪ�أ������������Ӧˮ����Ϊǿ�ᣬû��ָ����ۣ����Ӧ�һ��Ϊǿ�ᣬ������ᣬ��B����C��R(Na)Ϊ���ý������ֱ���X(H)��Y(O)��M(Cl)��ɵĶ�Ԫ�������ж��������Ӽ�����C��ȷ��D��������RYXΪNaOH��RMYΪNaClO����������������ˮ�ĵ��룬�����������ܹ��ٽ�ˮ�ĵ��룬��D����ѡC��
=-12����c(H+)=c(OH-)��10-12�����ˮ�����ӻ���֪c(OH-)c(OH-)��10-12=10-14����c(OH-)=0.1mol/L��˵��Q��ҺΪһԪǿ���QΪNaOH������ԭ��������С��֪XΪH��YΪO��RΪNaԪ�أ���X��M��ɵĻ�����XM��ǿ����ʣ�M��ԭ����������Na����MΪClԪ�ء�A��RΪNa��YΪO��MΪClԪ�أ����ӵĵ��Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ���ͬʱ�����ӵĺ˵����Խ�����Ӱ뾶ԽС��������Ӱ뾶��M��Y��R����A������B��MΪClԪ�أ������������Ӧˮ����Ϊǿ�ᣬû��ָ����ۣ����Ӧ�һ��Ϊǿ�ᣬ������ᣬ��B����C��R(Na)Ϊ���ý������ֱ���X(H)��Y(O)��M(Cl)��ɵĶ�Ԫ�������ж��������Ӽ�����C��ȷ��D��������RYXΪNaOH��RMYΪNaClO����������������ˮ�ĵ��룬�����������ܹ��ٽ�ˮ�ĵ��룬��D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ����������Һ�У��ܴ��������������Ϊ
A.Na+��K+��SO42-��HS-B.Na+��K+��SiO32-��NO3-
C.Na+��K+��Cl-��SO42-D.Fe3+��NO3-��SO42-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����20mL 0.1 mol/L��CH3COOH��Һ����εμ�0.1 mol/L��NaOH��Һ������NaOH��Һ���������ҺpH�ı仯��ͼ��ʾ������˵����ȷ����
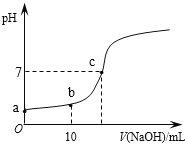
A. a���pH=1
B. b��ʱ��c (CH3COO��)=0.05mol/L
C. c��ʱ��V(NaOH)=20mL
D. ��Ӧ������![]() ��ֵ��������
��ֵ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ᴿ�������ʣ�������Ϊ���ʣ���ʹ�õ��Լ��ͷ��뷽������ȷ���ǣ� ��
���� | �Լ� | ���뷽�� | |
�� | ����أ��Ȼ��ƣ� | ����ˮ | ���½ᾧ |
�� | ������̼���Ȼ��⣩ | ����̼������Һ | ϴ�� |
�� | �Ҵ���ˮ�� | ��ʯ�� | ���� |
�� | �Ȼ�泥��Ȼ����� | ����������Һ | ���� |
A.�٢�B.�٢�C.ֻ�Т�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�Na2S��Һ��KMnO4��Һ��Ӧ��̽���������¡�
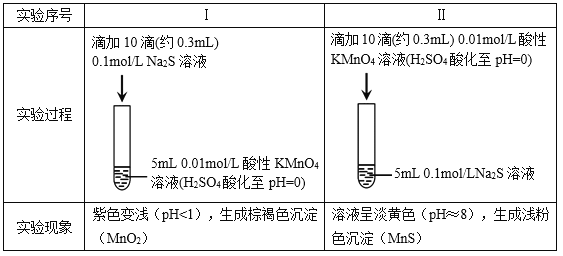
���ϣ���. ![]() ��ǿ���������±���ԭΪMn2+���ڽ����������±���ԭΪMnO2��
��ǿ���������±���ԭΪMn2+���ڽ����������±���ԭΪMnO2��
��. �����������������Һ����Һ�ʵ���ɫ��
��1������ʵ���֪��Na2S����________�ԡ�
��2����ͬѧԤ��ʵ��I��S2�C��������![]() ��
��
�ٸ���ʵ��������ͬѧ��Ϊ��Ԥ�ⲻ������������________��
����ͬѧȡʵ��I��������Һ����ʵ�飬����![]() ���ó�S2�C��������
���ó�S2�C��������![]() �Ľ��ۣ���ͬѧ���˸ý��ۣ�������________��
�Ľ��ۣ���ͬѧ���˸ý��ۣ�������________��
��ͬѧ�Ǿ����ۺ����������ʵ�飬֤ʵ��������![]() ��ȷ���Խ�S2�C������
��ȷ���Խ�S2�C������![]() ��
��
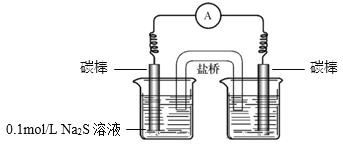
a.�Ҳ��ձ��е���Һ��________��
b.��ͨ�������ָ��ƫת��һ��ʱ���________�������������
��3��ʵ��I������������i���ڲ��죬��ԭ���������ɵIJ��Mn2+��������ķ�Ӧ�![]() ��������Ӧ���÷�Ӧ�����ӷ���ʽ��________��
��������Ӧ���÷�Ӧ�����ӷ���ʽ��________��
��4��ʵ��II������������Ҳ����ȫ�������ͬѧ������ԭ���루3�����ƣ�����֤�������������ʵ�鷽����______��
��5����˼��ʵ�飬��Ӧ����ͬ��������ͬ�����������ʱ仯�������������������йأ�����________�����йء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������Һ��pH���ﵽ����������ӵ�Ŀ�ġ����ܽ��������������ڲ�ͬpH�µ��ܽ��(S/mol/L)��ͼ��ʾ��

��1����pH��3ʱ����Һ��ͭԪ�ص���Ҫ������ʽ��__________��
��2����Ҫ��ȥCuCl2��Һ�е�����Fe3����Ӧ�ÿ�����Һ��pHֵΪ______ (�����)��
A����1����B��4���ҡ� C��8��PH��6 D����9
��3����Ni(NO3)2��Һ�к���������Co2�����ʣ�________(������������������)ͨ��������ҺpH�ķ�������ȥ��������_____________________________________________��
��4����֪һЩ���ܵ���ʵ��ܶȻ����������±���
���� | FeS | MnS | PbS | HgS | ZnS | CuS |
Ksp | 6.3��10��18 | 2.5��10��13 | 3.4��10��28 | 6.4��10��33 | 1.6��10��24 | 1.3��10��35 |
Ϊ��ȥij��ҵ��ˮ�к��е�Cu2����Pb2����Hg2�����ʣ���������˹�ҵ��ˮ�м��������___________(�����)��
A��NaOH�� ��B��FeS���� ��C��Na2S D��NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ����ķ�����ᴿ�������õķ����У����ˡ�������������ȡ�����������ȷֽ�ȣ����и�������ķ�����ᴿӦ����ʲô������
��1��ʵ�����е�ʯ��ˮ���ã�Һ���ϳ�������CaCO3���������ķ�����ȥCa��OH��2��Һ��������CaCO3������
��2��ʵ��������ȡ��Fe��OH��3�����г�����������Cl�� �� �����ķ�����ȥFe��OH��3�����л��е�����Cl�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����¶Ⱥ�ѹǿ�£�a�����X2�����3a�����Y2���廯������2a��������廯�����û�����Ļ�ѧʽ�ǣ� ��
A.XY3B.XYC.X3YD.X2Y3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ũ�Ⱦ�Ϊ0.1 mol![]() ��������Һ����Na2CO3 ��NaHCO3 ��HCl ��NH3��H2O
��������Һ����Na2CO3 ��NaHCO3 ��HCl ��NH3��H2O
��1�����˳���Һ�������۵ġ������ԭ����_____________________�������ӷ���ʽ���ͣ�
��2����������Һ��ˮ�ĵ���̶��ɴ�С��˳���ǣ��������д��______________________
��3������м��������Ȼ�粒��壬��ʱ![]() ��ֵ___________���������С�����䡱����
��ֵ___________���������С�����䡱����
��4���������Ϣۺܵ͢���Һ����ʱ��Һ��[NH4+]+[NH3��H2O]��_____________mol��L��1������ֵ������ʱ��Һ������Ũ�ȵĴ�С˳���ǣ�__________________________�������ۺܵ͢���Һ��Ϻ���Һǡ�ó����ԣ�����ǰ�۵����_________�ܵ����������ڡ�С�������ڡ���
��5����10 mL��Һ�ۼ�ˮϡ����100 mL�����ʱ��Һ����ˮ�������c( H��)=___________ mol��L��1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com