
【题目】如表为元素周期表前四周期的一部分,下列有关R,W,X,Y,Z五种元素的叙述中,正确的是( ) 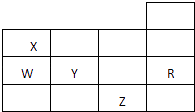
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y,Z的阴离子电子层结构都与R原子的相同
C.Y的氢化物的沸点比H2O的沸点高
D.Y元素的非金属性比W元素的非金属性强
【答案】D
【解析】解:根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,
A.常压下S、P为固体,而Br2为液体,所以五种元素的单质中Z单质的沸点不是最高的,故A错误;
B.Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故B错误;
C.水分子之间含氢键,沸点大于Y的氢化物,故C错误;
D.同周期中,从左到右,元素的非金属性逐渐增强,即非金属性Y>W,故D正确;
故选D.
根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,
A.根据物质的在常压下的存在形式可知,常压下S、P为固体,而Br为液体;
B.Y的阴离子核外有18个电子,Z的阴离子核外有36个电子;
C.根据水分子之间含有氢键进行比较;
D.同周期中,从左到右,元素的非金属性逐渐增强.


科目:高中化学 来源: 题型:
【题目】中华民族为人类文明进步做出巨大贡献。下列说法中不正确的是( )
A.商代后期铸造出工艺精湛的铜合金司母戊鼎,铜属于金属晶体
B.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
C.宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜
D.“文房四宝”中的砚台是用石材制作而成的,制作过程发生化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量__________(填“大于”、“等于”或“小于”)途径II放出的热量。
②b 与a、c、d的数学关系式是___________________ 。
(2)甲醇是一种重要的试剂,有着广泛的用途,工业上可利用CO2制备甲醇。用CH4与CO2反应制H2和CO,再利用H2和CO化合制甲醇。已知:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
则H2和CO制液态甲醇的热化学方程式为______________________________________。
(3)如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.

报据要求回答相关问题:
①写出甲中通甲醚一极的电极反应式______________________________。
②乙中发生的总反应的离子方程式为________________________________。
③将0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100ml溶液,用惰性电极电解一段时间后,某一电极上析出了0.3mol Cu,此时在另一电极上产生的气体体积(标准状况)为______________ L,若要使电解质溶液恢复到电解前的状态,需要加入固体的质量为_____________g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。
Ⅰ.实验步骤
(1)配制100ml待测白醋溶液:用 (填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴 作指示剂。
![]()
(3)读取盛装0.1000 mol·L-1 NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
(4)滴定。当___________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00[ | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可得c(市售白醋)= mol·L-1;
市售白醋总酸量= g·100 mL-1。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中杂质(括号内为杂质)的除杂试剂和除杂方法都正确的是
物质及其杂质 | 除杂试剂 | 除杂方法 | |
A | CO2(SO2) | 饱和碳酸钠溶液 | 洗气 |
B | NH4Cl(I2) | 无 | 加热 |
C | Cl2 (HCl) | NaOH溶液 | 洗气 |
D | FeCl2(FeCl3) | 过量Fe粉 | 过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入300 mL 浓度为lmol/L的NaOH 溶液中恰好完全反应,加热少许时间后溶液中形成NaCl、NaClO及NaClO3的共存体系.下列判断不正确的是
A. n(Na+):n(C1-)可能为7:3
B. n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2
C. 参加反应氯气物质的量为0.15mol
D. 反应中转移电子物质的量n的范围:0.15mol<n<0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:________。
(2)装置B中饱和食盐水的作用是______;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是_________(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是______,该现象____(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是________。
(5)装置F的烧杯中的溶液不能选用下列中的_________(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____.反应放出的热量___(填“大于”“小于”或“等于”)184.8 kJ。
(2)降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____,密度____.平衡常数K_________(填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com