
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。
Ⅰ.实验步骤
(1)配制100ml待测白醋溶液:用 (填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴 作指示剂。
![]()
(3)读取盛装0.1000 mol·L-1 NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
(4)滴定。当___________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00[ | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可得c(市售白醋)= mol·L-1;
市售白醋总酸量= g·100 mL-1。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
【答案】I.(1)酸式滴定管(或10mL移液管);100ml容量瓶;(2)酚酞;(3)0.60;(每空1分)
(4)溶液由无色恰好变为红色(或粉红色),并在半分钟内不褪色;(2分,)
III.(1)0.75;4.5;(每空2分)(2)ab(2分,错选、多选不给分,漏选给1分)
【解析】
试题分析:Ⅰ.(1)用酸式滴定管(或10mL移液管)(量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL 容量瓶中定容,摇匀即得待测白醋溶液;
(2)食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞;
(3)滴定管液面的读数0.60mL;
(4)NaOH滴定食醋的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅲ.(1)第1次滴定误差明显大,属异常值,应舍去;3次消耗的NaOH溶液的体积为:15.00mL;15.05mL;14.95mL;则NaOH溶液的体积的平均值为15.00mL;设10mL市售白醋样品中 CH3COOH 的物质的量浓度为x,则
CH3COOH~NaOH
1mol 1mol
0.2x 0.1000mol/L×0.015L
则c(市售白醋)=![]() =0.75mol/L
=0.75mol/L
样品总酸量为0.75mol/L×0.2L×60g/mol×![]() =4.50g/100mL;
=4.50g/100mL;
(2)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=![]() 分析可知c(待测)偏大,a正确;b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
分析可知c(待测)偏大,a正确;b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 分析可知c(待测)偏大,b正确;c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=
分析可知c(待测)偏大,b正确;c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=![]() 分析可知c(待测)不变,c错误;d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=
分析可知c(待测)不变,c错误;d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=![]() 分析可知c(待测)偏小,d错误;答案选ab。
分析可知c(待测)偏小,d错误;答案选ab。


科目:高中化学 来源: 题型:
【题目】今年春天以来,内蒙古自治区降水较常年偏少、气温偏高。进入7月以后,全区过半地域最高温度超过30℃以上,中西部地区有17个站点,最高温度超过35℃,阿拉善盟极高温度达到40℃。旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是______________________。
(2)在由水电离产生的c(H+)=1×1014molL-1的溶液中①NH4+、A13+、Br-、SO42-;②Na+、Mg2+、Cl-、NO3-;③K+、Ba2+、Cl-、NO3-;④K+、 Na+、HCO3-、SO42-四组离子中。一定可以大量共存的是______(填序号,下同),可能大量共存的是_____________。
(3)在下列中,水既不作氧化剂又不作还原剂是_____________(填序号)。
A.Cl2+H2O- =HCl+HClO B.2Na2O2+2H2O==4NaOH+O2↑
C.CaH2+2H2O==Ca(OH)2+2H2↑ D.3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
(4)将钠、钾分别投入有少量相同质量的稀H2SO4中,反应结束后,两种溶液的质量仍相等而金属均无
剰余,则投入的钠、钾的质量比为_____________。
(5)三氟化氮(NF3)是一种无色无味的气体,27.0mL NF3和水充分反应,生成18.0mLNO(同温、同压下),
写出反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数据记录合理的是
A. 用托盘天平称取5.85 g食盐
B. 用10 mL量筒量取8.36 mL稀硫酸
C. 用广泛pH试纸测得某溶液pH值为5.5
D. 用酸式滴定管移取高锰酸钾溶液19.10 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用蛋白质的变性可以为我们日常生活和医疗卫生服务。下列实例与蛋白质变性无关的是( )
A. 利用高温、紫外线对医疗器械进行消毒 B. 将鸡蛋蒸煮后食用
C. 给重金属中毒的病人服用蛋白质 D. 胃蛋白酶帮助人体消化食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2LNaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,回答下列问题: 
(1)该混合溶液中,Na+的物质的量为mol,MgCl2的物质的量为mol,Cl﹣的物质的量为mol.
(2)该混合溶液中含溶质的总质量为g.
(3)将该混合溶液加水稀释至体积为 1L,稀释后溶液中Cl﹣的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E是原子序数依次增大前20号元素。A原子价电子层p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素。回答下列问题:
(1)A的元素符号为 ___________、 B3+的结构示意图为___________、C的最高价氧化物对应水化物为____________;E的价电子排布式为______________。
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是___________,(填写化学式)碱性最强物质的电子式为_____________; D所在周期(除稀有气体元素外)第一电离能最小的元素是_________;在AD3分子中A元素原子的杂化方式是__________,分子空间构型为_______________;
(3)准晶是一种无平移周期序但有严格准周期位置序的独特晶体,可通过____________方法区分晶体、准晶体和非晶体。
(4)C单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_____,列式表示Al单质的密度____________________g·cm﹣3(不必计算出结果)。
(5)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表前四周期的一部分,下列有关R,W,X,Y,Z五种元素的叙述中,正确的是( ) 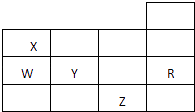
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y,Z的阴离子电子层结构都与R原子的相同
C.Y的氢化物的沸点比H2O的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com