
【题目】下列物质中,既能跟盐酸反应,又能跟NaOH反应的是( )
A. H2 B. SO2 C. Cu D. Al2O3
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。
Ⅰ.实验步骤
(1)配制100ml待测白醋溶液:用 (填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴 作指示剂。
![]()
(3)读取盛装0.1000 mol·L-1 NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
(4)滴定。当___________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00[ | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可得c(市售白醋)= mol·L-1;
市售白醋总酸量= g·100 mL-1。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:________。
(2)装置B中饱和食盐水的作用是______;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是_________(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是______,该现象____(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是________。
(5)装置F的烧杯中的溶液不能选用下列中的_________(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3ˉ+Ba2++OH-= BaCO3↓+H2O
B. 单质铜与稀硝酸反应:Cu + 2H+ +2NO3- = Cu2+ + 2NO +H2O
C. 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+ = Ca2++H2O+CO2↑
D. 实验室用MnO2和浓盐酸制取Cl2: MnO2+4HCl(浓)![]() Mn2+ + 2Cl- + Cl2↑ + 2H2O
Mn2+ + 2Cl- + Cl2↑ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习。对于H2SO4分类不合理的是( )
A. 酸 B. 含氧酸 C. 无氧酸 D. 强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____.反应放出的热量___(填“大于”“小于”或“等于”)184.8 kJ。
(2)降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____,密度____.平衡常数K_________(填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂--磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。
(1)写出基态Cu2+的电子排布式:_______________。
(2)PO43-的空间构型是___________________。
(3)P、S元素第一电离能大小关系为_____________________。
(4)氨基乙酸铜分子结构如图,碳原子的杂化方式为_____________,基态碳原子核外电子有__________个空间运动状态。
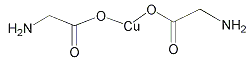
(5)铜晶体密堆积方式如图所示,铜原子的配位数为___________,铜的原子半径为127.8pm,NA表示阿伏加德罗常数的值,列出晶体铜的密度计算式_________g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com