
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:________。
(2)装置B中饱和食盐水的作用是______;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是_________(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是______,该现象____(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是________。
(5)装置F的烧杯中的溶液不能选用下列中的_________(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液
【答案】 Ca(ClO) 2+4HCl(浓)=CaCl2+2Cl2↑+2H2O 除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱 d E中溶液分为两层,上层(苯层)为紫色 不能 过量的Cl2也可将I-氧化为I2 b
【解析】本题考查氯气的实验室制取方法和氯气氧化性的验证的实验题目,实验室中可采用漂白粉与浓盐酸发生氧化还原反应来制取氯气,生成的氯气中含有挥发出来的氯化氢气体和水蒸气,用饱和食盐水吸收氯化氢气体,用装置C验证干燥的氯气无漂白性,潮湿的氯气才有漂白性,氯气与碘化钾溶液反应生成碘单质,碘单质溶于苯中显橙红色,可以证明氯气具有氧化性,氯气有毒,最后用碱溶液吸收,防止污染环境。
(1)漂白粉的主要成分是Ca(ClO)2,具有氧化性,HCl具有还原性,两者发生氧化还原反应,+1价的Cl和-1价的Cl发生归中反应,生成Cl2,化学方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
(2)氯气中含有挥发出来的氯化氢气体,氯化氢气体极易溶于水,而氯气在饱和食盐水中的溶解度较低,故饱和食盐水的作用是除去氯气中的氯化氢;C中如果发生堵塞,B中的氯气增多,压强变大,将会使B装置中的饱和食盐水进入长颈漏斗中,长颈漏斗中液面上升,形成水柱,故B可起安全瓶的作用,故本空答案为:B中长颈漏斗中液面上升,形成水柱。
(3)干燥的氯气无漂白性,氯气和水反应生成的HClO才有漂白性,故潮湿的氯气才具有漂白性。B装置中出来的是潮湿的氯气,选项a :I处放干燥的有色布条,布条褪色,Ⅱ处放碱石灰,得到干燥的氯气,但Ⅲ处放的湿润的有色布条也会褪色,Ⅲ处应该放置干燥的有色布条,a错误。选项b : Ⅱ处的硫酸铜粉末主要是检验水的存在,不适宜干燥气体,b错误。C选项中的浓硫酸应放置在试剂瓶中,不能放置在U形管中,c错误。d选项:氯气通过I处湿润的有色布条褪色,再经过无水氯化钙干燥,Ⅲ处干燥的有色布条不褪色,可以说明干燥的氯气无漂白性,潮湿的氯气才有漂白性,d 正确,答案选d。
(4)D中Cl2与NaBr发生置换反应生成液态溴单质,将溶有溴单质的D中的溶液滴入碘化钾溶液中,Br2与KI发生置换反应生成I2,I2单质易溶于苯中,显紫红色,又因为苯的密度小于水且不溶于水,所以混合溶液分两层,上层为溶有I2 的苯溶液显紫红色,下层为近乎无色的水层。D中溶液中还含有溶于水的Cl2,也能将I-氧化为I2单质,出现和上面相同的实验现象,故该现象不能说明溴单质的氧化性强于碘,本题的答案为:E中溶液分为两层,上层(苯层)为紫红、 不能、过量的Cl2也可将I-氧化为I2。
(5)氯气有毒,不能排放在空气中,可以用饱和NaOH溶液吸收: Cl2+2NaOH =NaCl+NaClO+H2O,也可用饱和Na2CO3溶液吸收:Cl2+H2O + 2Na2CO3 =NaClO + NaCl + 2NaHCO3,Ca(OH)2在水中的溶解度不大,所以饱和Ca(OH)2溶液的浓度较小,吸收氯气不充分,故不能用饱和Ca(OH)2溶液吸收氯气,答案选b。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列数据记录合理的是
A. 用托盘天平称取5.85 g食盐
B. 用10 mL量筒量取8.36 mL稀硫酸
C. 用广泛pH试纸测得某溶液pH值为5.5
D. 用酸式滴定管移取高锰酸钾溶液19.10 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表前四周期的一部分,下列有关R,W,X,Y,Z五种元素的叙述中,正确的是( ) 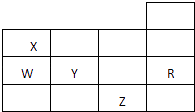
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y,Z的阴离子电子层结构都与R原子的相同
C.Y的氢化物的沸点比H2O的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素(1-8)在表中的位置,用化学用语回答下列问题:

(1)画出元素⑦的原子结构示意图__________。
(2)写出元素③的气态氢化物的电子式________。写出元素②的单质与元素⑧最高价含氧酸浓溶液的化学反应方程式__________。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________。(用元素形成的酸的化学式表示)
(4)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(5)由表中元素形成的物质X、Y、Z、M、N可发生以下反应,其中物质X、Y、N均为两种元素组成的物质。

X溶液与Y溶液反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,等物质的量的A和B发生反应:A(g)+2B(g) ![]() 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A. 40% B. 50% C. 60% D. 70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )

A. x的位置是第2周期、第ⅠA 族
B. 离子半径的大小顺序:e+>f 3+>g2->h-
C. 由x、z、d三种元素形成的化合物可能含有离子键
D. 简单气态氢化物的稳定性大小顺序: d>g>h
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖宝宝”的主要原料有铁粉、活性炭、水、食盐等,其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液.下列有关“暖宝宝”的说法错误的是
A.“暖宝宝”使用前要密封保存,使之与空气隔绝
B.“暖宝宝”放出的热量是铁发生氧化反应时产生的
C.活性炭作用是作原电池正极,加速铁粉的氧化
D.活性炭最终将转化为二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com