
【题目】锂--磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。
(1)写出基态Cu2+的电子排布式:_______________。
(2)PO43-的空间构型是___________________。
(3)P、S元素第一电离能大小关系为_____________________。
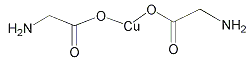
(4)氨基乙酸铜分子结构如图,碳原子的杂化方式为_____________,基态碳原子核外电子有__________个空间运动状态。
(5)铜晶体密堆积方式如图所示,铜原子的配位数为___________,铜的原子半径为127.8pm,NA表示阿伏加德罗常数的值,列出晶体铜的密度计算式_________g·cm-3。

【答案】 3d9 正四面体 P>S sp3 sp2 6 12 ![]()
【解析】(1)铜的原子序数是29,则基态Cu2+的电子排布式为3d9。(2)PO43-中P原子的价层电子对=4+(5+3-4×2)/2=4,且不含孤电子对,所以其空间构型正四面体。(3)P的3p轨道电子处于半充满状态,稳定性强,能量较低,则P、S元素第一电离能大小关系为P>S;(4)氨基乙酸铜的分子中一种碳有碳氧双键,C原子含有3个σ键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,C原子含有4个σ键,碳的杂化方式为sp3杂化;C原子具有6个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有6种不同的运动状态。(5)根据图可知,Cu的晶胞为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子位于面心上,每个顶点Cu原子为12个面共用,所以Cu的配位数为12;铜晶体为面心立方最密堆积,则每个晶胞中含有铜的原子:8×1/8+6×1/2=4,Cu原子半径为r=127.8pm=1.278×10-8cm,设晶胞的边长为d,则有![]() ,所以d=
,所以d= ![]() ,所以晶体铜的密度为:
,所以晶体铜的密度为: 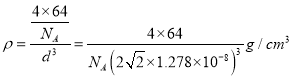 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】“暖宝宝”的主要原料有铁粉、活性炭、水、食盐等,其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液.下列有关“暖宝宝”的说法错误的是
A.“暖宝宝”使用前要密封保存,使之与空气隔绝
B.“暖宝宝”放出的热量是铁发生氧化反应时产生的
C.活性炭作用是作原电池正极,加速铁粉的氧化
D.活性炭最终将转化为二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素的性质及其递变规律正确的是( )
A.IA族与ⅦA族元素间形成的化合物都是离子化合物
B.第三周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,其单质的氧化性越强
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丙烯为原料合成抗炎药物D和机体免疫增强制剂Ⅰ的合成路线如下(部分反应条件和产物己经略去):
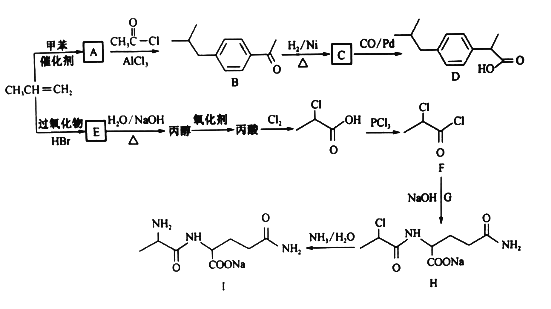
已知: +HCl
+HCl
回答下列问题:
(1)A的结构简式________,由H生成I的反应类型为______________。
(2)E的名称为_____________。
(3)化合物G的化学式为C5H10O3N2,则其结构简式为___________________。
(4)由E生成丙烯的化学方程式为 __________________________________。
(5)分子式为C9H10O2的有机物J和D是同系物,J的结构共有________种。
(6)结合上述流程中的信息,设计由制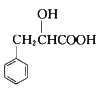 制备
制备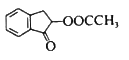 的合成路线:_________________。(其他试剂自选)
的合成路线:_________________。(其他试剂自选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
在以上制备甲醇的两个反应中:反应I优于反应II,原因为_____________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)ΔH1=-Q1 kJ/mol
②2CO(g)+ O2(g)=2CO2(g) ΔH2=-Q2 kJ/mol
③H2O(g)=H2O(l) ΔH3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:_______。
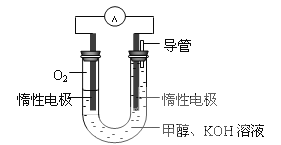
(3)某同学依据甲醇燃烧的反应原理,设计如下图所示的电池装置,工作一段时间后,测得溶液的pH将___________填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:________________。
Ⅱ 325K、起始压强为100kPa时,在体积为2L的密闭容器中充入4.6 g NO2 ,发生反应:2NO2(g)![]() N2O4(g)。
N2O4(g)。
(1)NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为________;

A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(2)能够说明上述反应已经达到平衡状态的有____________;
a.NO2和N2 O4的物质的量相等
b.体系颜色不在变化
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化
(3)若达到平衡后容器内混合气体的平均相对分子质量为57.5。平衡时NO2的转化率为_______,此条件下的平衡常数K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存于同一水溶液中的是
A. HCO3- 、Na+、K+、H+ B. NO3-、Cl-、Na+、Ag+
C. Mg2+、K+、NO3-、OH- D. Cu2+、H+、Na+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com