
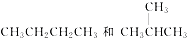
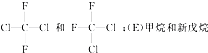
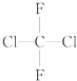
 和
和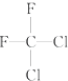 都代表二氟二氯甲烷,为同一种物质;
都代表二氟二氯甲烷,为同一种物质;

 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已吸潮 |
| B、向容量瓶中加水时液面低于刻度线即摇匀 |
| C、有少量NaOH溶液残留在烧杯内 |
| D、没有洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) |
| C、0.1 mol/L 的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | a | b | c | d |
| X | 温度 | 温度 | 加入H2的物质的量 | 加入E的物质的量 |
| Y | E的物质的量 | 平衡常数K | E的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解除去 |
| B、向沸水中滴加FeCl3饱和溶液制各Fe(OH)3胶体的原理是加热促进了Fe3+水解 |
| C、向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D、胶体区别于其它分散系的本质特征是分散质微粒直径在1 nm~100 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅的化学性质不活泼,常温下不与任何物质反应 |
| B、硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 |
| C、硅的化学性质不活泼,在自然界中可以以游离态存在 |
| D、硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com