
【题目】某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
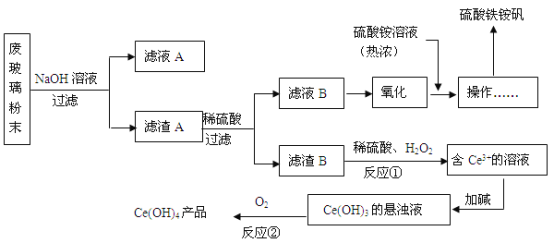
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式)________________________________。
(2)滤液A的主要成分_______________(填写化学式)。
(3)反应①的离子方程式是_____________________________。
(4)反应②的化学反应方程式是__________________________。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是_________。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3(水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3(有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是___(从平衡移动角度回答)。
【答案】Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ Na2SiO3 2CeO2 + H2O2+ 6H+=2Ce3++O2↑+4 H2O 4Ce(OH)3+O2+2H2O=4Ce(OH)4 77.12g 加入硫酸,可使平衡向左进行,使Ce3+进入水层(或答加入硫酸,平衡左移)
Fe(OH)3(胶体)+3H+ Na2SiO3 2CeO2 + H2O2+ 6H+=2Ce3++O2↑+4 H2O 4Ce(OH)3+O2+2H2O=4Ce(OH)4 77.12g 加入硫酸,可使平衡向左进行,使Ce3+进入水层(或答加入硫酸,平衡左移)
【解析】
废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等)加入氢氧化钠溶液,SiO2能和NaOH反应生成Na2SiO3,滤液A中含有Na2SiO3,滤渣A中含有Fe2O3、CeO2、FeO,向滤渣中加入稀硫酸,Fe2O3和FeO溶于稀硫酸,而CeO2不溶于稀硫酸,滤液B中含有硫酸铁和硫酸亚铁,氧化硫酸亚铁为硫酸铁,再加入硫酸铵溶液,得到硫酸铁铵矾。滤渣B中含有CeO2,加入稀硫酸提供酸性环境,用H2O2还原CeO2得到含Ce3+的溶液,然后加碱得到Ce(OH)3悬浊液,最后用氧气氧化得到Ce(OH)4。
(1)硫酸铁铵矾溶于水电离出Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中的悬浮物,达到净水的目的,其原理用离子方程式表示为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(2)工业废玻璃粉末含有的成分为SiO2、Fe2O3、CeO2、FeO等,与NaOH溶液反应,SiO2与氢氧化钠反应生成硅酸钠和水,其余均不反应,所以滤液A的主要成分是Na2SiO3。
(3)CeO2不溶于稀硫酸,根据流程图可知,滤渣B为CeO2,CeO2与稀硫酸、H2O2反应生成含Ce3+的溶液,Ce元素得电子,则H2O2中氧元素失电子生成氧气,根据化合价升降总数相等和原子守恒配平,则反应①的离子方程式是2CeO2+H2O2+6H+= 2Ce3++O2↑+4 H2O。
(4)反应②为加热Ce(OH)3的悬浊液得到Ce(OH)4,Ce元素的化合价由+3价失电子生成+4价的Ce,则空气中的氧气得电子生成-2价OH-,根据化合价升降总数相等和原子守恒配平,化学反应方程式为4Ce(OH)3+O2+2H2O = 4Ce(OH)4。
(5)13.2g (NH4) 2SO4(式量132)的物质的量为0.1mol,根据氮守恒,理论上生成的硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的物质的量也是0.1mol,其产率为80%,所以实际生成的硫酸铁铵矾晶体的物质的量为0.08mol,为0.08mol×964g/mol=77.12g。
(6)根据Ce2(SO4)3(水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+3H2SO4(水层),加入硫酸,可使平衡向左进行,使Ce3+进入水层。
2CeT3 (有机层)+3H2SO4(水层),加入硫酸,可使平衡向左进行,使Ce3+进入水层。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是:
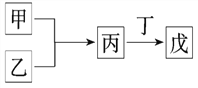
A. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
C. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
D. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
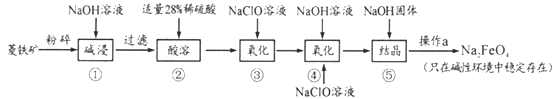
(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列仪器组装一套石油分馏的装置,并进行相关实验,可以得到汽油和煤油。

(1)写出下列仪器的名称:
①________;②________;③________。
(2)将以上仪器按从左到右的顺序,用字母a、b、c……进行连接:e接(____)接(____)接(____)接(____)接(____)接(____)接(____)接(____)接(____)。
(3)仪器②中A是________(填“进水口”或“出水口”,下同),B是________。
(4)蒸馏时,温度计水银球应在________(位置)。
(5)在①中注入原油后,加几片碎瓷片的目的是_______
(6)在实验结束后,为了探究石油中是否含有烯烃,某学生用③中的物质做了一个探究实验,其操作、现象及结论是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的资源,其中包括钠离子、氯离子、镁离子等。
(1)氯元素位于元素周期表第________列,写出氯原子的最外层电子排布式________________, 最外层电子所占据的轨道数为________ 个,氯原子核外共有________种能量不同的电子。
(2)列举能说明Mg的金属性比Na弱的一个实验事实__________________。
(3)相同压强下,部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/℃ | 1266 | 1534 | 183 |
试解释上表中熔点SiF4远低于NaF的原因_________________________
(4)氨水是实验室最常用的弱碱,向滴有少量酚酞试液的稀氨水,加入少量的NH4AC晶体,若观察到________________则可证明一水合氨是弱电解质。请再提出一个能证明一水合氨是弱电解质的实验方案 ______________________________________
(5)向盐酸中滴加氨水至过量,该过程所发生反应的离子方程式为___________________
在滴加的整个过程中离子浓度大小关系可能正确的是(______)
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)= c(OH-) >c(H+)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感冒是一种常见的病,病人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。药物阿司匹林是一种传统的治疗感冒发烧的药,从分子结构上看,它可以看做是乙酸酯,其结构简式为
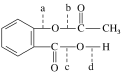
(1)阿司匹林与NaOH溶液反应中,可以断裂的化学键是________(填代号)。
(2)根据阿司匹林的结构推断它能够发生的化学反应类型为________(填序号)。
①中和反应 ②加成反应 ③取代反应
(3)阿司匹林连接在某高分子聚合物上,可形成缓解长效药物,其中的一种结构为
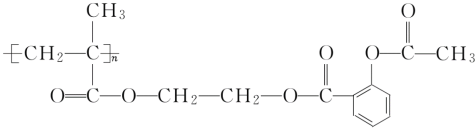
则缓释长效阿司匹林载体的结构简式为_______。
(4)长期大量服用阿司匹林会出现不良反应,一旦出现水杨酸中毒现象,应立即停药,并静脉滴注NaHCO3溶液,以解除水杨酸的中毒症状,反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化合物】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。

已知:
请回答:
(1)写出下列反应方程式
①B+D→E______________________________________。
②G→H________________________________________。
(2)①的反应类型为__________;②的反应类型为__________;F的结构简式为__________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体的结构简式。要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com