
| A、滤液中一定有Fe(NO3)3 |
| B、滤渣只含Ag和Cu,一定无Zn |
| C、滤渣中一定有Ag、Cu和Fe,一定无Zn |
| D、滤渣中可能有Ag、Cu、Fe和Zn |


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
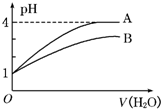 常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )
常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )| A、A酸比B酸的电离程度小 |
| B、pH=1时,B酸的物质的量浓度比A酸大 |
| C、B酸比A酸容易电离 |
| D、A是强碱,B是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
| A、电离能力:HCO3->HSO3->HClO |
| B、结合H+的能力:SiO32->CO32->SO32- |
| C、6种溶液中,Na2SiO3溶液中水的电离程度最小 |
| D、若要增大新制饱和氯水中HClO的浓度,可向其中加入Na2SiO3或Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制的氯水可使干燥的有色布条褪色 |
| B、新制的氯水呈黄绿色是因为在溶液中溶有氯气分子 |
| C、与久置氯水不同,在新制氯水中加入硝酸银溶液后无白色沉淀 |
| D、氯水久置后,会使溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、H+、Cl-、CO32- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、Ca2+、Cl-、NO3- |
| D、K+、H+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu(OH)2+HCl;NaOH+HNO3 |
| B、NaHCO3+H2SO4;Na2CO3+HCl |
| C、NaHSO4+NaOH;H2SO4+NaOH |
| D、BaCl2+H2SO4;Ba(OH)2+H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com