
【题目】下列说法正确的是
A. 铜锌原电池中,盐桥中的K+和NO![]() 分别移向负极和正极
分别移向负极和正极
B. SiO2(s)+2C(s)===Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
C. 室温下,将Na2CO3和NaHCO3的混合溶液加水稀释,![]() 减小
减小
D. 电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于6.02×1022
【答案】B
【解析】
A.原电池中阳离子向正极迁移,阴离子向负极迁移,所以盐桥中的K+向正极迁移,NO3-向负极迁移。A项错误;
B.该反应熵增加(即△S>0),因高温下才能发生反应,低温下不能反应,即低温下△H-T△S>0,所以△H>0。B项正确;
C.因为混合溶液中存在HCO3-![]() H++CO32-平衡,其平衡常数K=
H++CO32-平衡,其平衡常数K=![]() ,即
,即![]() =
=![]() ,K只与温度有关,加水稀释过程中K值不变,而c(H+)增大,所以
,K只与温度有关,加水稀释过程中K值不变,而c(H+)增大,所以![]() 增大,C项错误;
增大,C项错误;
D. 电解精炼铜时,阴极只有Cu2+放电:Cu2++2e-=Cu,3.2 g铜的物质的量=![]() =0.05mol,所以阴极得到电子的物质的量为0.05mol×2e-=0.1mole-,即6.02×1022个电子,根据电解池中电子转移守恒可知阳极失去的电子数也为6.02×1022。D项错误;答案选B。
=0.05mol,所以阴极得到电子的物质的量为0.05mol×2e-=0.1mole-,即6.02×1022个电子,根据电解池中电子转移守恒可知阳极失去的电子数也为6.02×1022。D项错误;答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铍的性质类似于铝,下列有关铍性质的推断中,正确的是( )
A.铍能与冷水反应
B.氢氧化铍既可以与盐酸反应又可与NaOH溶液反应
C.氧化铍的化学式为Be2O3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
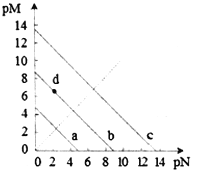
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1﹣18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
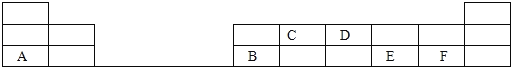
(1)画出D的原子结构示意图________;
(2)写出C的最高价氧化物的电子式________,该化合物所含化学键为____;
(3)E和F分别形成的气态氢化物中最稳定的是____(填写氢化物的化学式);
(4)A最高价氧化物的水化物与B的最高价氧化物的水化物的化学反应方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是______(填序号,下同)。
2SO3(g)达到平衡状态的是______(填序号,下同)。
(2)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_______。(注:B、C、D均为无色物质)
C(g)+D(g)达到平衡状态的是_______。(注:B、C、D均为无色物质)
II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
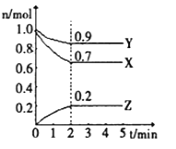
(1)反应开始至2min,以气体Y表示的平均反应速率为________;
(2)该反应的化学方程式为___________;
(3)X的转化率___________,生成的Z的百分含量___________
(4)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.1mol·L1 CH3COOH溶液中加入0.1mol CH3COONa固体,平衡后则溶液中![]() _______(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:_______________
_______(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:_______________
(2)常温下向20mL 0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
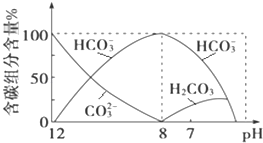
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有__________、________,溶液中含量最多的三种微粒的物质的量浓度的大小关系为_________;
③已知在25℃时,CO32-水解反应的平衡常数Kh═2×104mol·L1,当溶液中c(HCO3-):c(CO32-)=2∶1时,溶液的pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:

(1)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________;
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,写出有关镍元素的加压酸浸的化学反应方程式______________________;
(3)向浸出液A中通入H2S气体,反应的离子方程式是____________________;
(4)“高温熔融”时能否将通入氩气换为CO并说明原因_____________________;
(5)“碱浸”的目的是使镍铝合金产生多孔结构,从而增强对氢气的强吸附性,此过程
中发生反应的离子方程式为___________________。浸出反应所用的NaOH溶液的浓度要大,若NaOH溶液较稀时,则会产生少量的Al(OH)3沉淀而阻止浸出反应的持续进行,请用化学反应原理加以解释:________________________。
(6)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→________________________。(示例:CuOCu2+Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶有气泡从溶液中冒出
B.黄绿色的氯水光照后颜色变浅
C.FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
D.2NO2(g)![]() N2O4(g)平衡体系中,加压缩小体积后颜色加深
N2O4(g)平衡体系中,加压缩小体积后颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
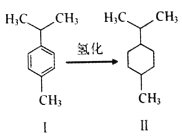
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com