
【题目】在1﹣18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
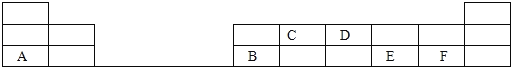
(1)画出D的原子结构示意图________;
(2)写出C的最高价氧化物的电子式________,该化合物所含化学键为____;
(3)E和F分别形成的气态氢化物中最稳定的是____(填写氢化物的化学式);
(4)A最高价氧化物的水化物与B的最高价氧化物的水化物的化学反应方程式____。
【答案】
![]() 共价键 HCl NaOH+Al(OH)3=NaAlO2+2H2O
共价键 HCl NaOH+Al(OH)3=NaAlO2+2H2O
【解析】
根据元素在周期表中的位置,可知A为Na,B为Al,C为C,D为N,E为S,F为Cl。
(1)D为N元素,为7号元素,其原子结构示意图为 ;
;
(2)C为C元素,其最高价氧化物为CO2,C原子最外层4个电子,达到稳定结构,需要形成4对共用电子对,O原子最外层有6个电子,达到稳定结构需要形成2对共用电子对,因此CO2分子中,1个C原子分别和2个O原子形成2对共用电子对,电子式为![]() ,所含化学键为共价键;
,所含化学键为共价键;
(3)同周期非金属元素的非金属性从左到右依次增强,元素的非金属性越强,其气态氢化物的稳定性越强,Cl的非金属性强于S,则HCl稳定;
(4)A的最高价氧化物的水化物为NaOH,B的最高价氧化物的水化物为Al(OH)3;两者反应生成NaAlO2和水,化学方程式为NaOH+Al(OH)3=NaAlO2+2H2O。


科目:高中化学 来源: 题型:
【题目】某同学进行了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
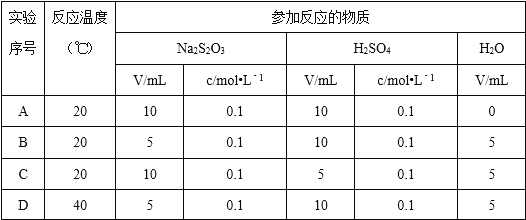
(1)写出上述反应的离子方程式__________。
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是__________(填实验序号)。
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。其中:
①能说明温度对该反应速率影响的组合比较是__________;(填实验序号)
②A和B、A和C的组合比较所研究的问题是__________;
③B和C的组合比较所研究的问题是__________;
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2、ZnC2、Al4C3、Mg2C3、Li2C2等同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A. Mg2C3水解生成丙炔B. Al4C3水解生成丙炔
C. ZnC2水解生成乙烷D. Li2C2水解生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 60g丙醇中存在的共价键总数为10NA
B. 乙烯和聚乙烯的混合物共7g,完全燃烧所生成的CO2的分子数一定为0.5NA
C. 标准状况下,2.24LCHCl3分子中含有0.3NA个Cl
D. 一定温度下,1L 1mol·L-1的CH3COONa溶液含NA个CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用乙醇和浓硫酸在170℃时制乙烯,化学反应原理为CH3CH2OH![]() CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):
CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):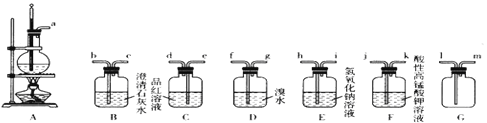
请回答下列问题:
(1)验证乙醇与浓硫酸混合反应产生了二氧化硫和二氧化碳。
①选择必要装置并进行连接:a→__________________(填接口序号)。
②确定混合气体中有二氧化碳存在的实验依据_________________________________。
(2)选择装置制备1,2—二溴乙烷。
①该同学设计的方案中装置连接顺序为A→E→D。此方案是否合理?_________(填“合理”或“不合理”);若不合理,请提出改进方案或方法____________________。
②分离出1,2—二溴乙烷的操作中使用的玻璃仪器为________________________。
③有同学建议在A、E之间增加G装置,其作用是_______,a与G装置接口_______(填“1”或“m”)连接。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铜锌原电池中,盐桥中的K+和NO![]() 分别移向负极和正极
分别移向负极和正极
B. SiO2(s)+2C(s)===Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
C. 室温下,将Na2CO3和NaHCO3的混合溶液加水稀释,![]() 减小
减小
D. 电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于6.02×1022
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN-
B.使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO![]()
C.能与Al反应放出大量H2的溶液中:NH![]() 、Na+、Cl-、HCO
、Na+、Cl-、HCO![]()
D.![]() =10-12的溶液中:Mg2+、Al3+、NO
=10-12的溶液中:Mg2+、Al3+、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,由CO2与H2反应可合成甲醇,反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是

A. 0~4 min 内,生成CO2的平均反应速率为0.025 mol·L-1·min-1
B. 第5 min 时在反应容器中加入了0.20 mol CO2和0.40 mol H2
C. 8 min后CH3OH的平衡浓度为0.425 mol·L-1
D. 前5 min CH3OH的转化率为20%,5~8 min H2的转化率为37.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com