
����Ŀ��ʵ���Һϳ��屽��װ��ͼ���й��������£������кϳɲ���ش�
�� | �� | �屽 | |
�ܶ�/g��cm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |

(1)ʵ��װ���У�����c������Ϊ__________________������Ϊ__________��
(2)��a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�壬��a�е��뼸���壬�а�������������Ϊ������________���壬�����μ���Һ����ꡣд��a�з�����Ӧ�Ļ�ѧ����ʽ��__________________��
(3)Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL 10%��NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ�����__________��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ���(һ�ָ����)�����á����ˡ�������ˮ�Ȼ��Ƶ�Ŀ����__________________��
(4)�����Ϸ���������屽�л����е���Ҫ����Ϊ______��Ҫ��һ���ᴿ������еIJ�������Ϊ________��
���𰸡����������� �������� HBr 2Fe+3Br2=2FeBr3��![]() +Br2
+Br2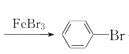 +HBr ��ȥδ��Ӧ��Br2 �����屽 �� ����
+HBr ��ȥδ��Ӧ��Br2 �����屽 �� ����
��������
���������ñ���Һ�������廯���������������£���������ƿ�ڷ���ȡ����Ӧ�Ʊ��屽����Ӧ������Ϊ��ֹҺ��ͱ��Ļӷ������ԭ�������ʣ��������ܽ�������������ͬʱ�������ɵ�HBr���壬�Է�ֹ������Ⱦ����Ӧ��Ļ����ͨ�����˳�ȥ��������ۣ�Ȼ��������������Һϴȥû�з�Ӧ���弰���ɵ�HBr������ˮ�Ȼ��Ƹ�����ٽ�����������ᴿ��
(1)���������ṹ��֪������c�����������ܣ�ʹ��װ�õ�Ŀ����ʹ�ӷ�����ͱ������������»ص���Ӧ�����ڣ����ԭ�������ʣ�
(2)����Һ�巢��ȡ����Ӧ�����屽��HBr����Ӧ����HBr������ˮ�����γɰ�����װ��a�з�����Ӧ�Ļ�ѧ����ʽΪ2Fe+3Br2=2FeBr3��![]() +Br2
+Br2 +HBr��
+HBr��
(3)�屽�ᴿ�ķ����ǣ�����ˮϴ���ѿ������ܽ���ˮ�У�Ȼ����˳�ȥδ��Ӧ����м���ڼ�NaOH��Һ��������Ӧ��2NaOH+Br2=NaBr+NaBrO+H2O��ʹδ��Ӧ��Br2���NaBr��NaBrO���뵽ˮ�У�
�ۼ���ˮ�Ȼ������������������ˮ�Ȼ��Ƶ������Ǹ����屽��
(4)�����������õ����屽����������δ��Ӧ�ı��������屽���ܣ������ߵķе㲻ͬ�������˵���ķе�ϵͣ����Բ�������ķ������з��롣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ���������ܱ������У��м����������ƶ�����߳���amolSO2��bmolO2���ұ߳���cmolSO2��dmolO2����ƽ��ʱ��ͼ����ʱ�����߸�����1mol��������һ��ʱ������´�ƽ�⣬����������SO2��ת������ԭƽ����Ƚ�

A. �������Ҽ��� B. ���С��������
C. ������ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������������й������ʵ��ƶ��У���ȷ����( )
A.��������ˮ��Ӧ
B.��������ȿ��������ᷴӦ�ֿ���NaOH��Һ��Ӧ
C.������Ļ�ѧʽΪBe2O3
D.������ֻ����ǿ����Һ��������ǿ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ������У���10mol CO��һ������H2S��ϼ��Ȳ��ﵽ����ƽ�⣺CO(g)+H2S(g) ![]() COS(g)+H2(g) K��1��ƽ���CO���ʵ���Ϊ8mol������˵����ȷ���ǣ� ��
COS(g)+H2(g) K��1��ƽ���CO���ʵ���Ϊ8mol������˵����ȷ���ǣ� ��
A.CO��H2S��ת����֮��Ϊ1��1
B.��ƽ���H2S���������Ϊ4%
C.�����¶ȣ�COSŨ�ȼ�С�������÷�Ӧ�����ȷ�Ӧ
D.��������ƽ����ϵ���ټ���CO��H2S��COS��H2��1mol��ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���������ʣ���ͭ�������ᱵ���壻���������ƹ��壻�ܰ�ˮ������������أ����Ҵ�����Һ̬�Ȼ��⣻��ʯī���������������ᡣ
�����ܵ������______�����ڷǵ���ʵ���______������ǿ����ʵ���______������������ʵ���______��
(2)����![]() ��
��![]() ����Һ��
����Һ��
��![]() ����
����![]() ����
����![]() ����
����![]() ����
����![]() ����
����![]() ����
����![]() ��
��
��pH�ɴ�С��˳����![]() �ñ�ű�ʾ
�ñ�ű�ʾ![]() ______��
______��
(3)�����½�![]() ����ˮ����Һ��pH______
����ˮ����Һ��pH______![]() ѡ����
ѡ����![]() ������
������![]() ������
������![]() ��
��![]() ����ԭ����
����ԭ����![]() �����ӷ���ʽ����뷽��ʽ��ʾ
�����ӷ���ʽ����뷽��ʽ��ʾ![]() ______��
______��
(4)��֪���������ʵ���Ũ����ͬ����������Һ��NaX��NaY��NaZ�����ǵ�pH����Ϊ10��9��8���֪���Ӧ��������HX��HY��HZ������ǿ��˳��Ϊ______��
(5)д������������ˮ����ˮ�ⷴӦ�����ӷ���ʽ��
�Ȼ���______��
����______��
�����______��
(6)���г�����pHΪ13��NaOH��ҺVmL��Ҫʹ����Һ��pH��Ϊ12���������![]() ��NaOH��Һ����Ҫ����______mL����������ԭNaOH��ҺͬŨ�ȵ�������Һ����Ҫ����______
��NaOH��Һ����Ҫ����______mL����������ԭNaOH��ҺͬŨ�ȵ�������Һ����Ҫ����______![]() �ú�V�Ĵ���ʽ��ʾ
�ú�V�Ĵ���ʽ��ʾ![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���仯�����ڹ�ҵ�����������о��зdz��㷺����;��
��1����Ŧ�Ʒ�����Ǧ������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ��H1��akJ��mol-1
��PbS(s)2PbO(s)=3Pb(s)+SO2(g) ��H2��b kJ��mol-1
��PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ��H3��c kJ��mol-1
��Ӧ3PbS(s)+6O2(g)=3PbSO4(s) ��H��____________kJ��mol-1���ú�a��b��c�Ĵ���ʽ��ʾ��
��2���Ժ�Ǧ���ϣ���Ҫ��Pb��PbO��PbO2��PbSO4��Ϊԭ���Ʊ��ߴ�PbO������Ҫ�������£�
�١����ܡ�ʱ����Fe2+���£�Pb��PbO2��Ӧ��1 mol PbSO4ʱת�Ƶ��ӵ����ʵ���Ϊ_________ mol��
����֪��PbO�ܽ���NaOH��Һ�У����ڻ�ѧƽ�⣺PbO(s)+NaOH(aq)![]() NaHPbO2(aq)�����ܽ��������ͼ1��ʾ��
NaHPbO2(aq)�����ܽ��������ͼ1��ʾ��

���������Ϣ������ɴ�ƷPbO���������ʲ�����NaOH��Һ���õ��ߴ�PbO�IJ���������ƷPbO�ܽ���һ����________���35������10��������NaOH��Һ�У�������110�棬����ܽ��_______________���� �����ȹ��ˡ�������Ũ������������Һ��ȴ�ᾧ�����ˡ�ϴ�Ӳ�����õ��ߴ�PbO���塣
��3������ƷPbO�ܽ���HCl��NaCl�Ļ����Һ�У��õ���Na2PbCl4�ĵ��Һ�����Na2PbCl4��Һ����Pb��װ����ͼ2��ʾ��

�������ĵ缫��ӦʽΪ______________________��
�ڵ���4.14gPb����ʱ��ͨ�����ӽ���Ĥ��n(H+)=______________________��
��4��PbI2�������˹����ꡣȡһ������PbI2���壬������ˮ���Ƴ�t�汥����Һ��ȷ��ȡ25.00 mL PbI2������Һ�ִμ��������ӽ�����֬RH+��������Ӧ��2RH++PbI2 =R2Pb+2H++2I-������250ml�ྻ����ƿ��������Һ����������ˮ��ϴ��֬������Һ�����ԣ���ϴ��Һһ��ʢ�ŵ���ƿ�У���ͼ3���������ָ̪ʾ������0.0050mol��L-1NaOH��Һ�ζ������ﵽ�ζ��յ�ʱ����ȥ����������Һ10.00mL���ɼ����t��ʱKsp(PbI2)Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��T��ʱ��Ksp(CaSO4)=4.90��10-5��Ksp (CaCO3)=2.8��10-9 Ksp(PbCO3)=8.4��10-14�������εij����ܽ�ƽ��������ͼ��ʾ��pM=-lgc������������pN=-lgc����������������˵���������
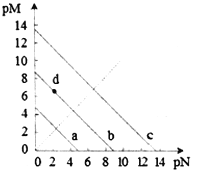
A. a����CaSO4�����ܽ�ƽ������
B. T��ʱ����10mLˮ�м���CaCO3��PbCO3�����߾����ͣ���Һ��c(Ca2+)��c(Pb2+)=
C. d���ʾCaCO3�ı�����Һ����c(Ca2+)<c(CO32-)
D. T��ʱ����CaSO4�����м���1mol��L-1��Na2CO3��Һ��CaSO4������ת��ΪCaCO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��18�ŵĶ���������Ԫ���У����е���ĸ����һ��Ԫ�أ��ش��������⣺
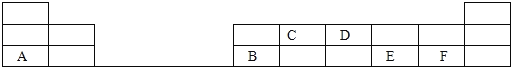
��1������D��ԭ�ӽṹʾ��ͼ________��
��2��д��C�����������ĵ���ʽ________���û�����������ѧ��Ϊ____��
��3��E��F�ֱ��γɵ���̬�⻯�������ȶ�����____����д�⻯��Ļ�ѧʽ����
��4��A����������ˮ������B������������ˮ����Ļ�ѧ��Ӧ����ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A.����ˮƿ�����ݴ���Һ��ð��
B.����ɫ����ˮ���պ���ɫ��dz
C.FeCl3��3KSCN![]() Fe��SCN��3��3KClƽ����ϵ�м����������ۣ���Һ��ɫ��dz
Fe��SCN��3��3KClƽ����ϵ�м����������ۣ���Һ��ɫ��dz
D.2NO2��g��![]() N2O4��g��ƽ����ϵ�У���ѹ��С�������ɫ����
N2O4��g��ƽ����ϵ�У���ѹ��С�������ɫ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com