
����Ŀ��ʵ���ҿ������Ҵ���Ũ������170��ʱ����ϩ����ѧ��Ӧԭ��ΪCH3CH2OH![]() CH2=CH2��+H2O������Ũ�������ǿ�����ԣ��ʸ÷�Ӧ�ĸ������ж�������Ͷ�����̼�ȡ�ijͬѧ����������Ϣ����Ӧ��ʵ��Ŀ��ѡ������ʵ��װ����ơ�ʵ��(ÿ��װ�ö������ɸ�)��
CH2=CH2��+H2O������Ũ�������ǿ�����ԣ��ʸ÷�Ӧ�ĸ������ж�������Ͷ�����̼�ȡ�ijͬѧ����������Ϣ����Ӧ��ʵ��Ŀ��ѡ������ʵ��װ����ơ�ʵ��(ÿ��װ�ö������ɸ�)��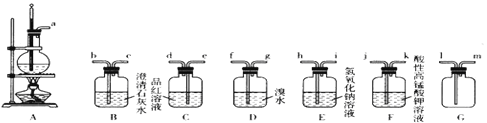
��ش��������⣺
��1����֤�Ҵ���Ũ�����Ϸ�Ӧ�����˶�������Ͷ�����̼��
��ѡ���Ҫװ�ò��������ӣ�a��__________________(��ӿ����)��
��ȷ������������ж�����̼���ڵ�ʵ������_________________________________��
��2��ѡ��װ���Ʊ�1��2���������顣
�ٸ�ͬѧ��Ƶķ�����װ������˳��ΪA��E��D���˷����Ƿ����?_________(���������������)������������������Ľ�������____________________��
�ڷ����1��2����������IJ�����ʹ�õIJ�������Ϊ________________________��
����ͬѧ������A��E֮������Gװ�ã���������_______��a��Gװ�ýӿ�_______(�1����m��)���ӡ�
���𰸡�e��d��f��g��e��d��b �ڶ���Cװ����Ʒ����Һ����ɫ��Bװ���г���ʯ��ˮ����� �������� ��E��D֮������һ��Cװ�ã� ��Һ©�����ձ��� ������(������ȫƿ) m
��������
��1�����Ҵ���Ũ���ᷴӦ��Ũ���������ˮ�ԣ��Ҵ�������̼����̼��Ũ������ȷ�Ӧ�ж�������Ͷ�����̼���ɣ���֤SO2��Ʒ����Һ����ɫ��ȥ˵����������SO2��Ȼ������ˮ��ȥ�����SO2����Ʒ����Һ֤��SO2�Ѿ���ȫ����ȥ�����ó���ʯ��ˮ֤��CO2�Ĵ��ڣ�����װ�õ�����˳��Ϊ��a��e��d��f��g��e��d��b��
�ڵ���һ��Cƿ��Ʒ����Һ����ɫ��Bƿ��Һ����ǣ���֤������������ж�����̼���ڣ�
��2���ٲ���������E��D֮������һ��Cװ�ã��Ʊ�1��2-���������װ��ΪA��E��C��D��
��1��2-�������鲻����ˮ������ͨ����Һ���������1��2-�������飬�õ�����Ҫ����Ϊ��Һ©�����ձ���
�۶�������Ͷ�����̼������������������Һ��Ӧ�����·���������������Gװ�ÿ��Է�ֹ���������˰�ȫƿ�����ã�a��Gװ�ýӿ�m���ӡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¡������ܱ������з�����Ӧ��Ni(s)+4CO(g)![]() Ni(CO)4(g)����H<0�����ø÷�Ӧ���Խ�����ת��Ϊ���ȴ�99.9���ĸߴ������Ը÷�Ӧ��˵����ȷ����
Ni(CO)4(g)����H<0�����ø÷�Ӧ���Խ�����ת��Ϊ���ȴ�99.9���ĸߴ������Ը÷�Ӧ��˵����ȷ����
A. ����Ni���������CO��ת���ʣ�Ni��ת���ʽ���
B. ��С�����ݻ���ƽ�����ƣ���H��С
C. ��Ӧ�ﵽƽ�����CO�ٴδﵽƽ��ʱ��CO�������������
D. ��4v[Ni(CO)4]=v(CO)ʱ�������л�������ܶȲ���ʱ������˵����Ӧ�Ѵﻯѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���仯�����ڹ�ҵ�����������о��зdz��㷺����;��
��1����Ŧ�Ʒ�����Ǧ������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ��H1��akJ��mol-1
��PbS(s)2PbO(s)=3Pb(s)+SO2(g) ��H2��b kJ��mol-1
��PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ��H3��c kJ��mol-1
��Ӧ3PbS(s)+6O2(g)=3PbSO4(s) ��H��____________kJ��mol-1���ú�a��b��c�Ĵ���ʽ��ʾ��
��2���Ժ�Ǧ���ϣ���Ҫ��Pb��PbO��PbO2��PbSO4��Ϊԭ���Ʊ��ߴ�PbO������Ҫ�������£�
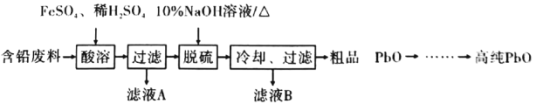
�١����ܡ�ʱ����Fe2+���£�Pb��PbO2��Ӧ��1 mol PbSO4ʱת�Ƶ��ӵ����ʵ���Ϊ_________ mol��
����֪��PbO�ܽ���NaOH��Һ�У����ڻ�ѧƽ�⣺PbO(s)+NaOH(aq)![]() NaHPbO2(aq)�����ܽ��������ͼ1��ʾ��
NaHPbO2(aq)�����ܽ��������ͼ1��ʾ��

���������Ϣ������ɴ�ƷPbO���������ʲ�����NaOH��Һ���õ��ߴ�PbO�IJ���������ƷPbO�ܽ���һ����________���35������10��������NaOH��Һ�У�������110�棬����ܽ��_______________���� �����ȹ��ˡ�������Ũ������������Һ��ȴ�ᾧ�����ˡ�ϴ�Ӳ�����õ��ߴ�PbO���塣
��3������ƷPbO�ܽ���HCl��NaCl�Ļ����Һ�У��õ���Na2PbCl4�ĵ��Һ�����Na2PbCl4��Һ����Pb��װ����ͼ2��ʾ��

�������ĵ缫��ӦʽΪ______________________��
�ڵ���4.14gPb����ʱ��ͨ�����ӽ���Ĥ��n(H+)=______________________��
��4��PbI2�������˹����ꡣȡһ������PbI2���壬������ˮ���Ƴ�t�汥����Һ��ȷ��ȡ25.00 mL PbI2������Һ�ִμ��������ӽ�����֬RH+��������Ӧ��2RH++PbI2 =R2Pb+2H++2I-������250ml�ྻ����ƿ��������Һ����������ˮ��ϴ��֬������Һ�����ԣ���ϴ��Һһ��ʢ�ŵ���ƿ�У���ͼ3���������ָ̪ʾ������0.0050mol��L-1NaOH��Һ�ζ������ﵽ�ζ��յ�ʱ����ȥ����������Һ10.00mL���ɼ����t��ʱKsp(PbI2)Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
A.��֤��Ȳ�����巢���ӳɷ�Ӧ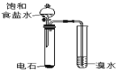
B.��֤����ˮ�������л�ԭ��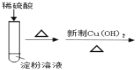
C.��֤�����鷢����ȥ��Ӧ������ϩ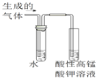
D.��֤̼�������ǿ�ڱ���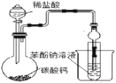
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��18�ŵĶ���������Ԫ���У����е���ĸ����һ��Ԫ�أ��ش��������⣺
��1������D��ԭ�ӽṹʾ��ͼ________��
��2��д��C�����������ĵ���ʽ________���û�����������ѧ��Ϊ____��
��3��E��F�ֱ��γɵ���̬�⻯�������ȶ�����____����д�⻯��Ļ�ѧʽ����
��4��A����������ˮ������B������������ˮ����Ļ�ѧ��Ӧ����ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к������Ľ���Ԫ�أ��䵥�ʺͻ�����㷺Ӧ�����ճ������С�
(1)���ۺ�����������(FeO-Fe2O3)��������ȼ����ں��Ӹֹ죬��Ӧ�Ļ�ѧ����ʽ��____��
(2)��������(��Ҫ�ɷ�ΪAl2O3.��SiO2��Fe2O3������)Ϊԭ�������������������[NH4Al(SO4)2��12H2O]��һ�ֹ����������£���֪:SiO2�ڡ����ܡ�ʱת��Ϊ��������(NaAlSiO4��nH2O)��������

��ʵ��ǰ��Ҫ��������۴��Ŀ����_______��
�������������ʽ��ʾ�������ƵĻ�ѧʽ________��
�۲�����漰�������ӷ���ʽ��: _______��
��д������Al2O3�Ʊ�����Al�Ļ�ѧ����ʽ: _______��
����ͬʱ��ȡ���������������ͨ����������������������ֲ�Ʒ�IJ���������ʹ�Ƶõ�������������������ʵ���֮��Ϊ1:1,��Ͷ��ʱ�������е�Al2O3��H2SO4�����ʵ���֮��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں���������ʵ���Һ�У������ж����ѧƽ��档
��1��һ���¶��£���1L 0.1mol��L1 CH3COOH��Һ�м���0.1mol CH3COONa���壬ƽ�������Һ��![]() _______������������������С����������������д����ʾ�û����Һ����������Ũ�ȼ��һ����ʽ��_______________
_______������������������С����������������д����ʾ�û����Һ����������Ũ�ȼ��һ����ʽ��_______________
��2����������20mL 0.1mol��L1 Na2CO3��Һ����μ���0.1mol��L1 HCl��Һ40mL����Һ�к�̼Ԫ�صĸ�������CO2���ݳ�δ���������ʵ�����������ҺpH�仯��������£�
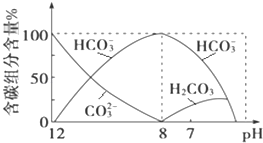
�ش��������⣺
����ͬһ��Һ�У�H2CO3��HCO3-��CO32-________�����������������������������棻
�ڵ�pH��7ʱ����Һ�к�̼Ԫ�ص���Ҫ����__________��________����Һ�к������������������ʵ���Ũ�ȵĴ�С��ϵΪ_________��
����֪��25��ʱ��CO32-ˮ�ⷴӦ��ƽ�ⳣ��Kh�T2��104mol��L1������Һ��c��HCO3-����c(CO32-)��2��1ʱ����Һ��pH��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�����������
A.��ͼ�������£�0.1 mol ��L��1����ϡ��ʱpH�����ˮ������仯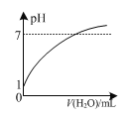
B.��ͼ��Ǧ���طŵ�ʱ������������Һ��pH��ʱ��ı仯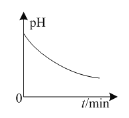
C.��ͼ����ͬѹǿ�£����淴ӦA(g)��B(g)![]() C(g)��D(s)��A��Ũ����ʱ��ı仯
C(g)��D(s)��A��Ũ����ʱ��ı仯
D.��ͼ��þ����������2 mol ��L��1�����У���������������ʱ��ı仯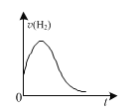
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ˮ���������Ҫ����֮һ�ǿ����������������������£�

�����ƶϲ���������
A.������ѭ�����õ�������SO2��Br2��Cl2���ȶ���
B.SO2������ķ�Ӧ����ʽ��SO2��2H2O��Br2��H2SO4��2HBr
C.�����ܴ��������������ӷ�������
D.û�в���ֱ�������庣ˮ�õ����������Ҫԭ����Ϊ�˽���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com