
【题目】下述实验方案能达到实验目的的是( )
A.验证乙炔可与溴发生加成反应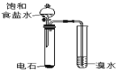
B.验证淀粉水解产物具有还原性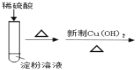
C.验证溴乙烷发生消去反应产生乙烯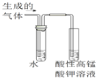
D.验证碳酸的酸性强于苯酚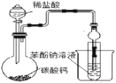
科目:高中化学 来源: 题型:
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/L NaOH溶液中加入0.2 mol/L HN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法正确的是( )
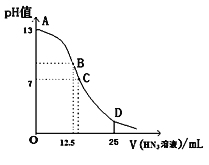
A. 该滴定过程中应用甲基橙作指示剂
B. 若B点pH=8,则c(HN3)=(10-6~10-8 )mol/L
C. 点D对应溶液中存在关系:c(HN3)>c(Na+)>c(N3-)
D. 沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,回答下列关于盐酸和醋酸溶液的问题:
①对于![]() 的盐酸和
的盐酸和![]() 的醋酸溶液的pH:盐酸______
的醋酸溶液的pH:盐酸______![]() 选填“
选填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 醋酸,写出醋酸的电离方程式______
醋酸,写出醋酸的电离方程式______![]() 若用同浓度的NaOH溶液分别中和等体积且pH相等的盐酸和醋酸溶液,则消耗NaOH溶液的体积关系为:前者______后者
若用同浓度的NaOH溶液分别中和等体积且pH相等的盐酸和醋酸溶液,则消耗NaOH溶液的体积关系为:前者______后者![]() 选填“
选填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() .
.
②两种酸均能与氢氧化钠反应生成盐,其中醋酸能与氢氧化钠反应生成醋酸钠.实验室现有醋酸钠固体,取少量溶于水,溶液呈______![]() 选填“酸性”、“中性”或“碱性”
选填“酸性”、“中性”或“碱性”![]() ,其原因是
,其原因是![]() 用离子方程式表示
用离子方程式表示![]() ______.
______.
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的![]() 时,溶液中离子物质的量的浓度大小关系为______;当测得溶液的
时,溶液中离子物质的量的浓度大小关系为______;当测得溶液的![]() 时,溶液中离子物质的量的浓度大小关系可能为
时,溶液中离子物质的量的浓度大小关系可能为![]() 写出一种关系即可
写出一种关系即可![]() ______.
______.
④已知![]() 时,
时,![]() 的醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由______.
的醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2、ZnC2、Al4C3、Mg2C3、Li2C2等同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A. Mg2C3水解生成丙炔B. Al4C3水解生成丙炔
C. ZnC2水解生成乙烷D. Li2C2水解生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,可逆反应 N2 + 3H2 ![]() 2NH3 达到平衡状态的标志是
2NH3 达到平衡状态的标志是
A.N2、H2、NH3 在容器中共存
B.混合气体的总物质的量不再发生变化
C.单位时间内生成 n mol N2,同时生成 3n mol H2
D.单位时间内消耗 n mol N2,同时消耗 n mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用乙醇和浓硫酸在170℃时制乙烯,化学反应原理为CH3CH2OH![]() CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):
CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):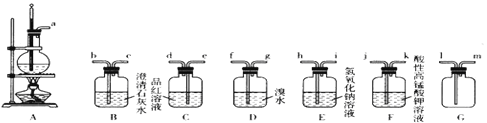
请回答下列问题:
(1)验证乙醇与浓硫酸混合反应产生了二氧化硫和二氧化碳。
①选择必要装置并进行连接:a→__________________(填接口序号)。
②确定混合气体中有二氧化碳存在的实验依据_________________________________。
(2)选择装置制备1,2—二溴乙烷。
①该同学设计的方案中装置连接顺序为A→E→D。此方案是否合理?_________(填“合理”或“不合理”);若不合理,请提出改进方案或方法____________________。
②分离出1,2—二溴乙烷的操作中使用的玻璃仪器为________________________。
③有同学建议在A、E之间增加G装置,其作用是_______,a与G装置接口_______(填“1”或“m”)连接。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 容器中有2HI(g)![]() H2(g)+I2(g),增大压强颜色变深
H2(g)+I2(g),增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com