
【题目】设氨水的![]() ,某盐酸的
,某盐酸的![]() ,已知
,已知![]() ,且
,且![]() 。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是
。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是
A.![]()
B.![]()
C.![]()
D.![]()
【答案】C
【解析】
常温下该氨水的pH=x,则氨水中c(OH-)=10x-14mol/L,该盐酸的pH=y,盐酸中c(H+)=10-ymol/L,由于x+y=14,则c(H+)=10-ymol/L=10x-14mol/L,所以氨水中c(OH-)与盐酸中c(H+)相等,一水合氨是弱电解质,氯化氢是强电解质,氨水浓度大于盐酸,二者等体积混合后氨水过量,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(NH4+)+c(H+)=c(Cl-)+c(OH-)可得:c(NH4+)>c(Cl-),所以溶液中离子浓度大小关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
故选:C。


科目:高中化学 来源: 题型:
【题目】一定温度下将0.2mol气体A充入10L恒容密闭容器中,进行反应:2A(g)+B(g) ![]() 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
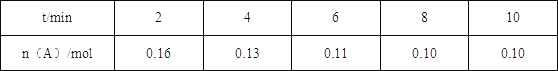
A.反应前2min的平均速率ν(C)=0.02molL﹣1min﹣1
B.平衡后降低温度,反应达到新平衡前ν(逆)>ν(正)
C.其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图一致的是:

A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) ![]() CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
D.图④ 中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式为( )
A.浓盐酸与铁屑反应:2Fe+6H+=2 Fe3++3H2↑
B.钠与 CuSO4 溶液反应: 2Na + Cu2+ = Cu 2Na
C.足量Na2CO3溶液中清入几滴稀H2SO4 :![]() + 2H+ = H2O + CO2
+ 2H+ = H2O + CO2
D.向 FeCl3 溶液中加入铜粉: Cu + 2Fe3+ = 2Fe2+ + Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A. 增加Ni的量可提高CO的转化率,Ni的转化率降低
B. 缩小容器容积,平衡右移,△H减小
C. 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D. 当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液一定呈酸性的是
A.一定体积![]() 的NaOH溶液加水稀释
的NaOH溶液加水稀释![]() 倍
倍
B.![]()
![]() 某碱溶液和
某碱溶液和![]()
![]() 盐酸等体积混合
盐酸等体积混合
C.![]()
![]() 氨水和
氨水和![]()
![]() 氯化铵溶液等体积混合
氯化铵溶液等体积混合
D.![]() 的NaOH溶液与
的NaOH溶液与![]() 的
的![]() 溶液等体积混合
溶液等体积混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
A.验证乙炔可与溴发生加成反应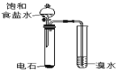
B.验证淀粉水解产物具有还原性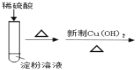
C.验证溴乙烷发生消去反应产生乙烯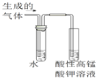
D.验证碳酸的酸性强于苯酚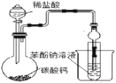
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com