
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、根据两个反应即可得出结论 |
| D、Ka(HCN)<Ka(HNO2 ) |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、制取相同量的硝酸铜时,③需硝酸的量最少 |
| B、制取相同量的硝酸铜时,①产生的有毒气体比②少 |
| C、三种方案中硝酸的利用率③>②>① |
| D、三种方案的反应都可以在铁制容器中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、纯碱、CaSO4 |
| B、盐酸、烧碱、CuSO4 |
| C、HNO3、乙醇、氯化钠 |
| D、碳酸、CaO、苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| 电解质 | 电离常数(mol?L-1) |
| H3PO4 | Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13 |
| HF | Ka=6.4×10-4 |
| CH3COOH | Ka=1.7×10-5 |
| NH3?H2O | Kb=1.7×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
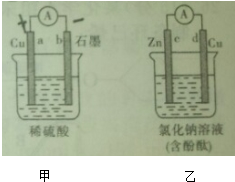
| A、甲溶液中H+的移动方向是a→b |
| B、b电极上的电极反应式为:2H++2e-═H2↑ |
| C、一段时间后,d电极附近的溶液变红 |
| D、乙装置中的溶液会逐渐变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔化时不导电 |
| B、不是离子化合物,而是极性共价化合物 |
| C、溶液中已电离的离子和未电离的分子共存 |
| D、水溶液的导电能力很差 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中的氧化剂只有CuSO4 |
| B、7 mol CuSO4能氧化5mol-1价的硫 |
| C、被氧化的硫和被还原的硫个数之比是3:7 |
| D、FeS2既是氧化剂,又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com