
【题目】已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的 ![]() 倍
倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
【答案】B
【解析】解:A、通入稀有气体总压增大,分压不变,平衡不动,故A错误; B、速率之比等于化学方程式的系数之比,v(X)正:v(Y)正=m:n,平衡时,X的正反应速率是Y的逆反应速率的 ![]() 倍,故B正确;
倍,故B正确;
C、反应是放热反应,降温平衡正向进行,反应前后气体体积减小,过程中气体质量不变,混合气体的相对分子质量增大,故C错误;
D、增加X的量会提高Y的转化率,Y的转化率降低,本身转化率减小;故D错误;
故选B.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 因发生加成反应,苯可以使溴水褪色
B. 煤可以通过干馏、液化与气化等物理变化转化为清洁能源
C. 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
D. 分子式为C8H10且属于芳香烃的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应是旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 mol共价键(或其逆过程)时释放(或吸收)的能量。已知下面化学键的键能: H—H Br—Br H—Br 键能(kJ·mol-1) 436 193 366,则Br2(g)+H2(g)=2HBr(g)的反应热ΔH等于( )
A. -183 kJ·mol-1B. 183 kJ·mol-1C. -103 kJ·mol-1D. 103 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液加入铝可以生成H2,则在该溶液中一定能大量存在的离子组是( )
A. K+、Cu2+、NO![]() 、Cl- B. K+、Na+、Br-、Cl-
、Cl- B. K+、Na+、Br-、Cl-
C. K+、Ca2+、HCO![]() 、Cl- D. Na+、Mg2+、Br-、SO
、Cl- D. Na+、Mg2+、Br-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中进行SO2的催化氧化反应.若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则下列叙述中正确的是( )
A.SO2的转化率为60%
B.SO3的产率为60%
C.平衡时总压强与起始压强之比为7:8
D.平衡时V(SO2):V(O2):V(SO3)=3:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液和100mL 0.5mol/L CaCl2溶液所含的Cl-物质的量浓度相同的是
A. 500mL 0.1mol/L MgCl2溶液 B. 100mL 0.5mol/L AlCl3溶液
C. 50mL 1mol/L NaCl溶液 D. 25mL 0.5mol/L HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是重要的有色金属之一,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用.现对粗镍进行提纯,具体的反应流程如下: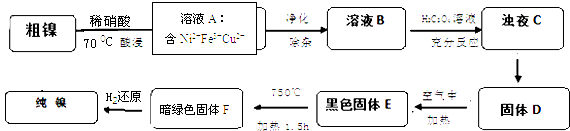
已知:
①2Ni2O3(黑色) ![]() 4NiO(黑色)+O2↑
4NiO(黑色)+O2↑
②
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
Ksp | 8.8×10﹣38 | 2.2×10﹣20 | 5.48×10﹣18 | 3.2×1018 |
根据信息回答:
(1)28Ni在周期表中的第周期;镍与稀硝酸反应的离子方程式为 . 实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3 . 为了得到纯净的溶液B还需要加入以下物质进行除杂(填正确答案标号).
A.NaOH
B.Na2S
C.H2S
D.NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4H2O>NiC2O42H2O.由浊液C得到固体D的操作包括过滤、、(填操作名称); D生成E的化学方程式为
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32﹣ , C2O42﹣、S2﹣等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)2C3(g);△H=﹣Q1 kJ/mol(Q1>0),在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2 , 在500℃时充分反应,达平衡后C3的浓度为w molL﹣1 , 放出热量为Q2 kJ.
(1)达到平衡时,A2的转化率为 .
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3 , 500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度(填>、=、<)w molL﹣1 , Q1、Q2、Q3 之间满足何种关系:Q3=
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是; 
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4molA2和2molB2 , 500℃时充分反应达平衡后,放出热量Q4kJ,则Q2Q4 (填“>”、“<”或“=”).
(6)下列措施可以同时提高反应速率和B2的转化率是(填选项序号). a.选择适当的催化剂 b.增大压强 c.及时分离生成的C3 d.升高温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制物质的量浓度为0.1 mol·L-1的Na2CO3溶液100 mL时,下列操作正确的是( )
A. 用托盘天平称取1.06 g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 定容时,若仰视,则所配溶液的浓度将偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com