
下列图示中能较长时间看到Fe(OH)2白色沉淀的有



A.Ⅰ、Ⅱ、Ⅳ
B.Ⅰ、Ⅱ、III、Ⅳ、Ⅵ
C.Ⅰ、III、Ⅴ
D.Ⅰ、Ⅱ、III、Ⅳ、Ⅴ、Ⅵ
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2.2 pH的计算试卷(解析版) 题型:选择题
在25 ℃的条件下,将体积都为10 mL,pH都等于3的醋酸和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积( )
A.a=b=10B.a=b>10 C.a< bD.a>b
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步练(人教选修4)2.3化学平衡状态的建立及标志(解析版) 题型:选择题
在恒温下的密闭容器中,有可逆反应:2NO+O2 2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.反应容器中压强不随时间的变化而变化
C.混合气体颜色保持不变
D.混合气体的平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铜及其化合物主要性质、合金(解析版) 题型:选择题
下列各组物质按下图所示转化关系每一步都能一步实现的是

| 甲 | 乙 | 丙 | 丁 |
A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
B | Cu | CuO | CuSO4 | CuCl2 |
C | NO | HNO3 | NO2 | NH3 |
D | Al(OH)3 | NaAlO2 | Al2O3 | AlCl3 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铜及其化合物主要性质、合金(解析版) 题型:选择题
中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲+乙—→丙+丁。下列说法正确的是
A.若甲为铜,丁为氯化亚铁,则乙一定是氯化铁
B.若甲为碳,丁为硅,则丙一定是二氧化碳
C.若甲为铝,丁为铁,则乙一定是氧化铁
D.若甲为镁,丁为氢气,则乙一定是酸
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:选择题
部分氧化的Fe?Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
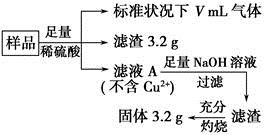
下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896 mL
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
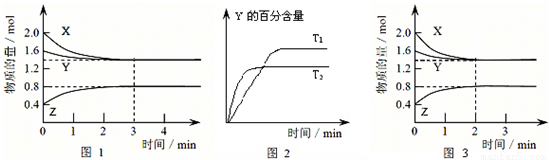 A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为3X(g)+Y(g)  2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
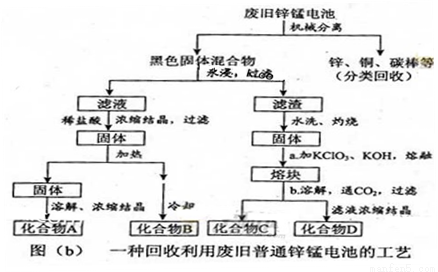
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是 。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com