
【题目】下列物质不属于电解质的是( )
A.NaB.H2SO4C.NaOHD.Na2SO4
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
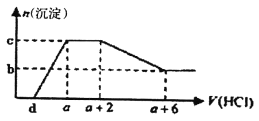
A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
A |
| 反应开始后,针筒活塞向右移动 |
B |
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块11.0 g的铁铝合金,加入一定量的稀硫酸后完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 mol ·L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是( )
A. 该合金中铁的质量为5.6 g
B. 该合金与足量氢氧化钠溶液反应,转移的电子数为0.6NA
C. 合金与稀硫酸反应共生成0.45 mol H2
D. 所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如下图所示:

该实验的主要操作步骤如下:
步骤一:
(1)①配制100 mL 1.0 mol·L-1的盐酸,需要20%,密度为1.1g·cm-3的盐酸的体积为______。
②配制过程中所需要的玻璃仪器有__________________________________________。
③下列操作会导致物质的量浓度偏大的是_________________
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中进行定容时仰视刻度线
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水
步骤二: 用量筒量取出10.0 mL 1.0 mol·L-1的盐酸加入锥形瓶中;
步骤三: (2)称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
步骤四: 往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
步骤五: (3)反应结束后待体系温度恢复至室温,读取量筒中水的体积为V mL。
①实验步骤五中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
②读数时除恢复到室温,视线与液体凹液面的最低处相平外,还要注意_____________________。
③若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算公式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤素的说法正确的是
A. “加碘食盐”中的“碘”是指I2 B. 液溴有强挥发性,保存时应加少量水液封
C. F2可以从NaCl水溶液中置换出Cl2 D. 卤化氢都易溶于水,其水溶液都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,氯化亚硝酰(NOCl)足一种红黄色气体,其熔点- 64.5℃,沸点-5.5℃,可被水分解,其一种制备原理为Cl2+2NO =2NOC1。实验装置如下图所示,回答下列问题:

(1)实验前须排尽装置I、Ⅱ、Ⅲ中的空气,其原因是__________________________。
(2)NO是用铜与稀硝酸反应制得,其离子方程式为__________________________。
(3)图中各装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
(4)装置I、Ⅱ的作用是观察气泡调节气体的流速和________________________________。
(5)装置V是为了吸收尾气,防止污染环境,其中吸收NOC1时反应的化学方程式为____________(非氧化还原反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)阿托酸乙酯可用于辅助胃肠道痉挛及溃疡。阿托酸乙酯的一种合成路线如下图所示: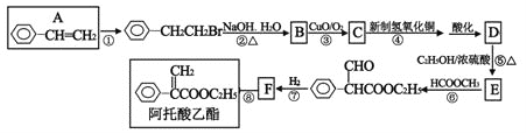
请回答下列问题:
(1)A的命名____________ E的分子式为_________F的结构简式_________ ①的反应类型_______
(2)在反应①②③④⑤⑥⑦⑧中,属于取代反应的有_____________;
(3)反应③的方程式_________________________________________。
(4)有关阿托酸乙酯的说法正确的是 (_______)
A.能使高锰酸钾褪色,不能使溴水褪色
B.1mol阿托酸乙酯最多能与4molH2加成
C.能发生加成、加聚、氧化、水解等反应
D.分子式为C11H13O2
(5)D的同分异构体有多种,符合含有苯环且能与碳酸氢钠反应放出气体的同分异构体有_________种(不包含D)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:

(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com