
【题目】(题文)掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO2和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SeO3(aq) △H2
H2SeO4(aq)+3SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
则△H2=_____________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS),羰基硫的结构式为____________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示,
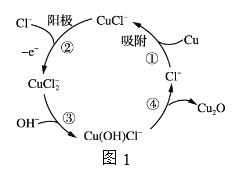
①阳极的电极反应式为_________________________。
②电解一段时间后,向电解液中补充一定量的_________________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按![]() =1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
=1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
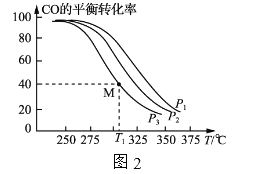
①a_____(填“>”或“<”)0;压强p1、p2、p3由小到大的顺序是___________________。
②T1℃时若向该容器中充入2.0molH2和2.0molCO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=____mol·L-1·min-1,M点对应条件下反应的平衡常数
为________________。
(5)将CuCl水解再热分解可得到纳米Cu2O。CuCl水解的反应为CuC(s) +H2O(l) ![]() CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
【答案】 2△H3- 3△H1 O=C=S CuCl--e-+Cl-=CuCl2- H2O(或“水”) < p321 ![]() 4.17V2
4.17V2 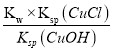
【解析】(1)已知:I、H2SeO3(aq)+2SO2(g)+H2O(l)═Se(s)+2H2SO4(aq) △H1
II、2H2SeO4(aq)+Se(s)+H2O(l)═3H2SeO3(aq) △H2
III、H2SeO4(aq)+3SO2(g)+2H2O(l)═Se(s)+3H2SO4(aq) △H3
将反应III×2I×3即可得到反应II,则反应II的反应热△H2=2△H33△H1;
(2)COS与CO2是等电子体,结构相同,羰基硫的结构式为O=C=S。
(3)①用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液得到氧化亚铜,阳极的电极反应:CuCl--e-+Cl-=CuCl2-,故答案为:CuCl--e-+Cl-=CuCl2-;②综合反应过程分析,实质是铜和水反应生成氧化亚铜和氢气,减少的是水,故答案为:水。
(4)①由图可知,温度一定时,CO的转化率α(P3)<α(P2)<α(P1),该正反应是气体体积减小的反应,增大压强平衡向正反应进行,CO的转化率升高,故压强P1>P2>P3,故答案为:p3<p2<p1。②CO的转化率为40%,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
2mol 2mol 0
0.8mol 1.6mol 0.8mol
1.2mol 0.4mol 0.8mol
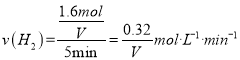
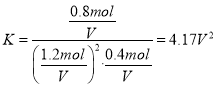
故答案为: ![]() ;4.17V2
;4.17V2
(5)CuCl(s)+H2O(l)CuOH(s)+Cl-(aq)+H+(aq),平衡常数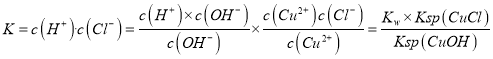 ,故答案为:
,故答案为: ![]()


科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,a、b均为惰性电极,在直流电场的作用下,中间隔室的Na+、SO42-可分别通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列有关说法正确的是
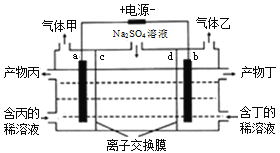
A. a极的电极反应式为2H2O+2e-=H2↑+2OH-
B. c为阳离子交换膜,d为阴离子交换膜
C. 气体乙为O2,产物丁为硫酸
D. 若撤去离子交换膜c、d再电解硫酸钠溶液,则不能制得硫酸和烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物性质的说法正确的是
A.乙烯和甲烷在一定条件下均可以与氯气反应
B.乙烯和聚乙烯都能使溴水褪色
C.乙烯和苯都能通过化学反应使酸性高锰酸钾溶液褪色
D.乙酸能与钠产生氢气,而乙醇不可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
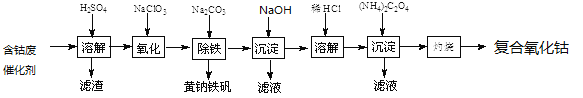
(1)用H2SO4溶解后过滤,得到的滤渣是_________(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____________________。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是___________________。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:_______________________。
(5)弱酸和弱碱的电离平衡常数的负对数可用pK表示,根据下表中数据判断(NH4)2C2O4溶液中各离子的浓度由大到小的顺序为__________________。
H2C2O4 | pKa1= l.25,pKa2=4.13 |
NH3·H2O | pKb=4.76 |
(6)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤其原因是_____________________。
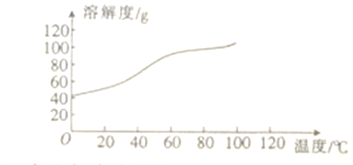
(7)准确称取1.470gCoC2O4,在空气中充分灼烧得0.814g复合氧化钴,写出复合氧化钴的化学式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定一定质量的钠与水反应产生的氢气的体积,设计了图装置进行实验。
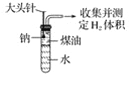
(1)实验开始,欲使钠与水接触反应,应如何操作?______________________________;反应开始后,试管中能观察到的现象是__________________________________________。
(2)已知有关物质的密度ρ(K):0.86 g·cm-3,ρ(Na):0.97 g·cm-3,ρ(煤油):0.8 g·cm-3。如果将钠换成相同大小的钾进行上述实验,结果钾反应完所用时间比钠反应完所用的时间________(填“长”或“短”),其原因是________________________________。
(3)从实验的安全考虑,比较金属钠、钾与水反应的实验操作图A、图B,请指出图B表示哪种金属与水反应____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.加热杀死流感H7N9病毒是因为蛋白质受热发生盐析
B.医用酒精灭活新冠肺炎病毒是利用其氧化性
C.我国研制的重组新冠疫苗无需冷藏保存
D.乙烯的产量通常用来衡量一个国家石油化工的水平
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com